
Wetenschap
Nanopore onthult vormveranderend enzym gekoppeld aan katalyse
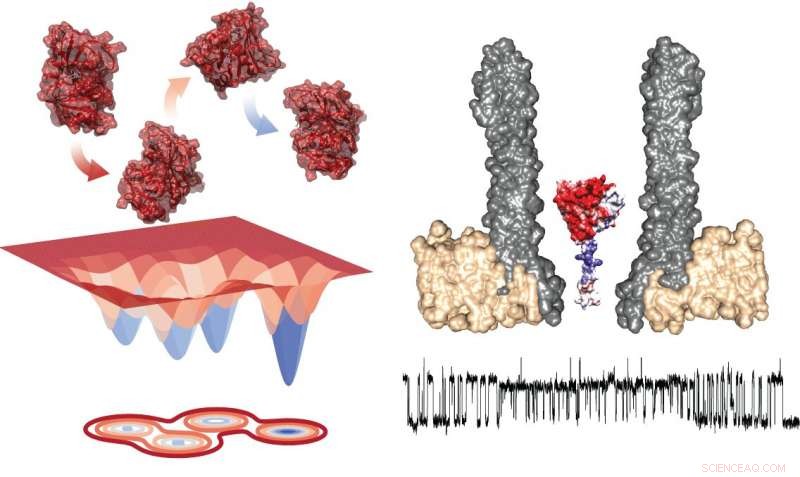
Energiediagram van de vier conformeren (links) en de experimentele opstelling die de nanoporie met het opgesloten enzym in dwarsdoorsnede toont (rechts). Onder, er is een typisch spoor dat metingen toont tijdens uitwisseling binnen rotamers. Krediet:Giovanni Maglia, Rijksuniversiteit Groningen
Wetenschappers van de Rijksuniversiteit Groningen hebben de kenmerken van een enkel enzym in een nanoporie waargenomen. Ze leerden dat het enzym in vier verschillende gevouwen toestanden kan bestaan, of conformeren, die een actieve rol spelen in het reactiemechanisme. Deze resultaten zullen gevolgen hebben voor enzymengineering en de ontwikkeling van remmers. De studie is gepubliceerd in Natuurchemie op 6 april.
Enzymen zijn gevouwen eiwitten met een specifieke driedimensionale structuur die een actieve plaats creëert die een substraat kan binden en een specifieke reactie kan katalyseren. In recente jaren, het is duidelijk geworden dat enzymen geen starre structuren zijn, maar dat de gevouwen eiwitten bestaan als een geheel van conformaties in evenwicht rond een energetisch stabiele grondtoestand.
Wind tunnel
Het bestuderen van de overgang tussen toestanden vereist het observeren van afzonderlijke enzymen gedurende een langere periode, wat uitdagend is. Universitair hoofddocent Chemische Biologie Giovanni Maglia van de Rijksuniversiteit Groningen ontwikkelde trechtervormige nanoporiën die eiwitten kunnen vangen. Door de ionenstroom te meten over zo'n nanoporie ingebed in een kunstmatig lipidemembraan, Maglia kon conformatieveranderingen in enzymen waarnemen. "Je zou het kunnen vergelijken met het bestuderen van een auto in een windtunnel, " legt hij uit. "Het openen van een raam of een deur zal de luchtstroom veranderen. Op een soortgelijke manier, een verandering in de vouwstructuur van het enzym verandert de ionenstroom door de porie."
Maglia gebruikte zijn nanoporiënsysteem om het enzym dihydrofolaatreductase (DHFR) te bestuderen, die dihydrofolaat omzet in tetrahydrofolaat. "We hebben voor dit enzym gekozen omdat het al meer dan 30 jaar wordt bestudeerd als een modelsysteem voor enzymdynamica, gebruikmakend van alle beschikbare technieken. In aanvulling, remmers van dit enzym, zoals methotrexaat, worden gebruikt als geneesmiddelen tegen kanker.
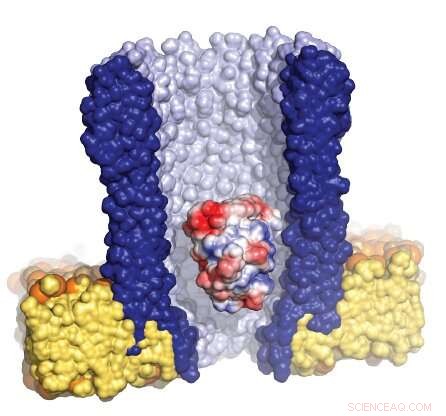
Illustratie van de trechtervormige nanoporie (blauw) omgeven door het kunstmatige membraan (geel), met een enkel enzym (rood/wit/blauw) gevangen in de porie. Krediet:Giovanni Maglia, Rijksuniversiteit Groningen
Efficiënte afgifte
Metingen van DHFR onthulden de aanwezigheid van vier conformeren met verschillende affiniteiten voor de substraten. Maglia zegt, "Het schakelen tussen deze vier toestanden ging erg traag. Dit betekent dat je ze alleen kunt zien in dit soort langdurige onderzoeken met enkelvoudig enzym."
Het toevoegen van de reactieremmer methotrexaat, die bindt aan het enzym, veroorzaakte een zeer snelle overgang tussen toestanden en veranderde de affiniteit van de enzymen. "Onze conclusie is dat de reacties van het enzym met verschillende verbindingen de vrije energie leveren voor conformationele veranderingen, ' zegt Maglia.
Verder, conformationele verandering veranderde ook de affiniteit van de enzymen. Dit slaat ergens op, omdat het enzym twee substraten moet binden en, na het voltooien van de reactie, moet beide vrijgeven. "Het substraat en het product zijn zeer vergelijkbare moleculen, dus het enzym moet zijn affiniteit veranderen voor een efficiënte afgifte."
Twee staten
Op basis van deze onderzoeken, Maglia kan zien dat het enzym tussen twee toestanden schakelt:na binding van het substraat, NADPH drijft de reactie aan, die vervolgens de conformatie van het enzym verandert en daarmee de affiniteit ervan. Vervolgens, het binden van een nieuw substraat brengt het terug naar de eerste staat. "Dit verklaart twee van de vier conformeren die we hebben waargenomen; we kunnen de andere twee nog niet begrijpen, ', zegt Maglia. Het is onmogelijk om structurele informatie uit de metingen af te leiden.
Hoe dan ook, de studie toont de kracht van nanopore-technologie aan bij het bepalen van de structurele veranderingen van enzymen. "We weten nu ook dat dit enzym vier verschillende grondtoestanden heeft en ertussen moet schakelen om te kunnen functioneren." Dit voegt een uitdaging toe aan het ontwerp van enzymen:dit moet niet alleen een reactief centrum produceren, maar het moet ook de nodige conformatieveranderingen mogelijk maken. Maglia:"Dit kan verklaren waarom kunstmatig ontworpen enzymen vaak niet zo efficiënt werken als natuurlijke enzymen." Eindelijk, de studie zal wetenschappers ook in staat stellen om nieuwe remmende geneesmiddelen te identificeren die sterker aan DHFR binden dan methotrexaat.
 Biostasis heeft tot doel de dood na traumatisch letsel te voorkomen door biochemische reacties in cellen te vertragen
Biostasis heeft tot doel de dood na traumatisch letsel te voorkomen door biochemische reacties in cellen te vertragen Blauwe gaten brengen vergeten scheikundige elementen terug op het podium
Blauwe gaten brengen vergeten scheikundige elementen terug op het podium Paddestoelen, veren combineren in biologisch afbreekbare schoenen
Paddestoelen, veren combineren in biologisch afbreekbare schoenen Onderzoeksteam ontdekt rubbermateriaal dat kan leiden tot krasvaste autolak
Onderzoeksteam ontdekt rubbermateriaal dat kan leiden tot krasvaste autolak Chemici gebruiken elektrochemie om de productie van medicijnen te versterken
Chemici gebruiken elektrochemie om de productie van medicijnen te versterken
 Bespaar thuis regenwater met een vegetarische moestuin
Bespaar thuis regenwater met een vegetarische moestuin Hoe een stofstorm en gevaarlijke luchtkwaliteit uw gezondheid kunnen schaden
Hoe een stofstorm en gevaarlijke luchtkwaliteit uw gezondheid kunnen schaden NASA vindt nog een klein gebied met sterke stormen in vervagende Flossie
NASA vindt nog een klein gebied met sterke stormen in vervagende Flossie Studie bevestigt plastic bedreiging voor zeevogels in de Stille Zuidzee
Studie bevestigt plastic bedreiging voor zeevogels in de Stille Zuidzee Hoe helpt zonne-energie het milieu?
Hoe helpt zonne-energie het milieu?
Hoofdlijnen
- Bloedbad vreest race om zeldzame Australische papegaai te redden
- Onderzoekers ontdekken een evolutionaire opstap naar bietenrode bieten
- Berekening van celconcentratie
- VS keuren herstelplan voor Mexicaanse wolven goed
- The Krebs Cycle Made Easy
- Het publiek is minder bang voor haaien als ze hun gedrag begrijpen
- Uitbreidingen van het cytoplasma
- Hoeveel onontdekte wezens zijn er in de oceaan?
- Vergeten is niet altijd slecht - het helpt ons betere beslissingen te nemen
- Blauwe paddestoelkleurstof gebruikt om nieuw fluorescerend hulpmiddel voor celbiologen te ontwikkelen

- Voor altijd vechten tegen chemicaliën met microben

- Nieuw superomnifoob glas zweeft hoog op vlindervleugels met behulp van machine learning

- Zullen lithium-luchtbatterijen ooit vliegen?

- Twee Frank-Kasper-fasen in zoutkristalstructuren waargenomen
 Geluid, trillingsherkenning stimuleert contextbewust computergebruik
Geluid, trillingsherkenning stimuleert contextbewust computergebruik De oudste bomen van de aarde in door het klimaat veroorzaakte racen de boomgrens op
De oudste bomen van de aarde in door het klimaat veroorzaakte racen de boomgrens op Hoe fotonen de chemie veranderen
Hoe fotonen de chemie veranderen VS worstelt om bij te blijven terwijl de hennepindustrie groeit
VS worstelt om bij te blijven terwijl de hennepindustrie groeit Computersimulaties onthullen wortels van resistentie tegen geneesmiddelen
Computersimulaties onthullen wortels van resistentie tegen geneesmiddelen Online Black Friday-verkopen in de VS bereikten record van $ 7,4 miljard
Online Black Friday-verkopen in de VS bereikten record van $ 7,4 miljard Hoe knaagdieren te identificeren aan de hand van hun uitwerpselen
Hoe knaagdieren te identificeren aan de hand van hun uitwerpselen 3D-weergave van Amazonebossen legt de effecten van El Nino-droogte vast
3D-weergave van Amazonebossen legt de effecten van El Nino-droogte vast
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

