
Wetenschap
Nieuwe inzichten in fermentatie-enzymen zullen de ecologische voetafdruk van de chemische industrie verkleinen
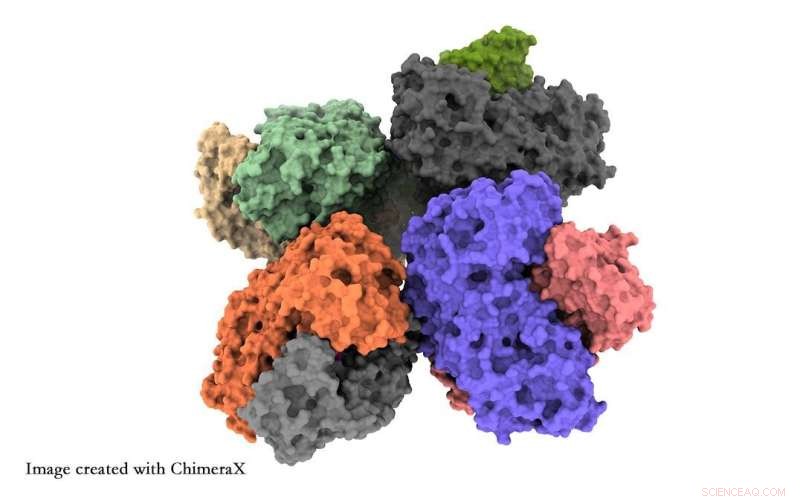
Onderzoekers van de Universiteit van Tsukuba hebben op atomair niveau inzicht gekregen in de structuur van het fosfoketolase-enzym, wat onderzoekers zal helpen dit enzym te optimaliseren voor de synthese van chemische grondstoffen. Krediet:Universiteit van Tsukuba
Farmaceutica, kunststoffen en andere industrieën gebruiken enzymen om moleculaire grondstoffen te synthetiseren. Enzymen die rechtstreeks uit microben zoals bacteriën worden gehaald, zijn vaak niet optimaal voor industrieel gebruik; een probleem is dat ze vaak de verhoogde temperaturen die een synthese versnellen, niet overleven. Genetische manipulatie kan helpen om enzymen voor deze doeleinden op maat te maken. Kennis van de exacte atoom-voor-atoomstructuur van het oorspronkelijke enzym is belangrijk om de enzymfunctie in de natuur te begrijpen, en geeft zo inzicht in hoe de genetische manipulatie van enzymen kan worden geoptimaliseerd. Röntgenkristallografie, een veelgebruikte techniek om de structuur van een enzym te bepalen als een cruciale stap in dit proces, kan helaas ook de structuur ervan veranderen.
Een techniek die bekend staat als cryogene elektronenmicroscopie (cryo-EM) kan een vergelijkbaar niveau van structurele details bieden als röntgenkristallografie, terwijl de structuur van het natieve enzym behouden blijft. De Nobelprijs voor Scheikunde 2017 werd zelfs toegekend voor het gebruik van deze techniek om de structuur van biologische moleculen te bepalen. Nu, in een recentelijk gepubliceerd onderzoek in het Journal of Structural Biology , hebben onderzoekers van de Universiteit van Tsukuba en samenwerkende partners cryo-EM gebruikt om de structuur van het fermentatie-enzym fosfoketolase te bepalen. Dit werk zal de genetische manipulatie van het enzym voor industriële syntheses vergemakkelijken.
"Röntgenkristallografie heeft een revolutie teweeggebracht in de manier waarop onderzoekers eiwitstructuren identificeren, maar de ontwikkeling van alternatieve middelen die de structuren in de biologie beter weerspiegelen, is van onschatbare waarde", legt senior auteur professor Kenji Iwasaki uit. "Ons gebruik van cryo-EM als beeldvormingsinstrument heeft eerder verborgen structurele details in fosfoketolase blootgelegd die direct ten goede komen aan de chemische industrie."
De onderzoekers rapporteren twee belangrijke bevindingen. Ten eerste clusteren acht fosfoketolase-eenheden samen in één structuur, bekend als een octameer. Ten tweede observeerden ze details van een keten van aminozuren die bekend staat als de QN-lus die kan bepalen of de functionele plaats van het enzym open of gesloten is. Dit is een mogelijke manier om de chemische output van het enzym te verbeteren.
Röntgenkristallografie verduistert het structurele detail van cryo-EM. Het octameer werd eerder waargenomen met röntgenkristallografie, maar men dacht dat het gewoon een meetartefact was. Bovendien mist röntgenkristallografie de open/gesloten structurele details.
"De industrie zal nu in staat zijn om de functie van fosfoketolase te correleren met de juiste structuur", zegt Iwasaki. "We verwachten dat deze inzichten onderzoekers eraan zullen herinneren dat röntgenkristallografie niet noodzakelijk het laatste woord is over de enzymstructuur; cryo-EM kan waardevolle inzichten bieden."
De resultaten van deze studie zijn belangrijk voor het optimaliseren van de prestatie van een fermentatie-enzym dat nuttig is voor het uitvoeren van chemische syntheses in de industrie. Door structurele inzichten van enzymen te gebruiken om het succes van genetische manipulatie te maximaliseren, kunnen grondstoffen worden geproduceerd voor geneesmiddelen, kunststoffen en andere materialen op een ecologisch duurzame manier. + Verder verkennen
Methaan-etende bacteriën zetten broeikasgas om in brandstof
 Waarom uien ons aan het huilen maken (en waarom sommigen niet)
Waarom uien ons aan het huilen maken (en waarom sommigen niet) Oude oorsprong van allosterische activering in de oudste kinasen
Oude oorsprong van allosterische activering in de oudste kinasen Hoe lang duurt het voordat piepschuim wordt afgebroken?
Hoe lang duurt het voordat piepschuim wordt afgebroken?  Het eerste nucleofiele goudcomplex
Het eerste nucleofiele goudcomplex Onderzoeksteam pioniert sneller, goedkopere en groenere manier om aminozuren te produceren uit plantaardig afval
Onderzoeksteam pioniert sneller, goedkopere en groenere manier om aminozuren te produceren uit plantaardig afval
 NASA-NOAA-satelliet ziet overblijfselen van tropische cycloon Owens reorganiseren
NASA-NOAA-satelliet ziet overblijfselen van tropische cycloon Owens reorganiseren Wijdverbreid risico op grondwaterverontreiniging door chroom
Wijdverbreid risico op grondwaterverontreiniging door chroom Wat zijn de oorzaken van de 4 seizoenen op aarde?
Wat zijn de oorzaken van de 4 seizoenen op aarde?  NASA-NOAA-satelliet ziet nieuwe tropische storm Rene die de Kaapverdische eilanden doordrenkt
NASA-NOAA-satelliet ziet nieuwe tropische storm Rene die de Kaapverdische eilanden doordrenkt Kunnen nanokristallen de volgende grote brandstofbron zijn?
Kunnen nanokristallen de volgende grote brandstofbron zijn?
Hoofdlijnen
- Waarom is diffusie belangrijk voor het leven van een cel?
- Waarom je moet letten op vliegend braaksel
- Wereldwijd onderzoeksteam vult taalkloof in plantenwetenschap
- Wat zijn de monomeren van triglyceriden?
- Voordelen en nadelen van XRD en XRF
- Omringd door zieke collega's? Je lichaam bereidt zich voor op de strijd
- Wat is een fossiel?
- Slechts een kleine hoeveelheid olie beschadigt de veren van zeevogels, blijkt uit onderzoek
- Prehistorische skeletten van vrouwen tonen impact van rigoureuze handenarbeid
- Een betere zoutvanger bouwen:wetenschappers synthetiseren een moleculaire kooi om chloride op te vangen
- Waarom we uitwisbare MRI-scans nodig hebben?

- Het mysterie openbreken hoeveel bubbels er in een glas bier zitten

- Nieuw apparaat voor snelle en nauwkeurige detectie van lood
- Onderzoekers ontwikkelen nieuw platform dat kanker in een schaal nabootst om snel de beste bacteriële therapie te bepalen
 10 geheime Amazon Prime-voordelen die u misschien niet kent
10 geheime Amazon Prime-voordelen die u misschien niet kent Oude eiwitten helpen bij het opsporen van vroeg melkdrinken in Afrika
Oude eiwitten helpen bij het opsporen van vroeg melkdrinken in Afrika Paniek kopen, veiligheidsmaatregelen negeren:de sociale psychologie van crises
Paniek kopen, veiligheidsmaatregelen negeren:de sociale psychologie van crises New Horizons halverwege Pluto naar volgende flyby-doel
New Horizons halverwege Pluto naar volgende flyby-doel Appartementen hebben zelden toegang tot laadstations. Maar elektrische voertuigen hebben ze nodig
Appartementen hebben zelden toegang tot laadstations. Maar elektrische voertuigen hebben ze nodig Tonga:heel land afgesneden van Facebook, YouTube
Tonga:heel land afgesneden van Facebook, YouTube Chipfout legt miljarden wifi-apparaten bloot
Chipfout legt miljarden wifi-apparaten bloot Neutronensterren op de rand van instorten
Neutronensterren op de rand van instorten
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

