
Wetenschap
Oude oorsprong van allosterische activering in de oudste kinasen
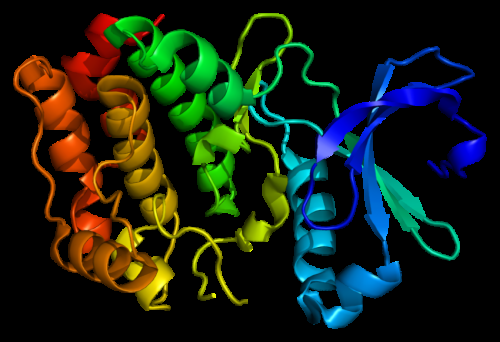
Structuur van het Aurora A-kinase-eiwit. Gebaseerd op PyMOL-weergave van moleculaire visualisatiesystemen van Protein Data Bank (PDB) 1mq4. Krediet:Gemaakt door Emw, Wikimedia CC BY-SA 3.0.
Een van de belangrijkste kenmerken in de evolutie van complexere organismen is de opkomst van allosterische regulatie. Allosterie is een proces waarbij de activiteit van een eiwit kan worden gemoduleerd door een effectormolecuul distaal van de actieve plaats te binden.
Ondanks het enorme belang van allosterie in de biologie, de vraag hoe een dergelijke functie zich heeft ontwikkeld, is onontgonnen terrein.
In een artikel dat op 22 februari online is gepubliceerd in Wetenschap , hoogleraar biochemie en Howard Hughes Medical Institute Investigator Dorothee Kern en haar laboratorium gaan in op wat misschien wel een van de meest fundamentele evolutionaire drijfveren voor biologie is:allotery.
Door het evolutionaire pad van moderne eiwitkinasen te volgen van hun oude gemeenschappelijke voorouders ongeveer 1,5 miljard jaar geleden tot heden, Kern en haar collega's ontdekten voor het eerst de oude oorsprong van allosterische regulatie.
Om zo'n fundamentele vraag te bestuderen, de onderzoekers kozen ervoor om de evolutie van Aurora-kinase samen met zijn allosterische regulator nieuw leven in te blazen, TPX2. Deze eiwitten regelen de celcyclus bij de mens en zijn daarom hete doelwit van kanker.
In de krant, de wetenschappers berekenden eerst de aminozuursequenties van deze oude eiwitten met behulp van de grootste sequentiedatabase die tot nu toe beschikbaar is en bio-informatica. Vervolgens maakten ze deze enzymen in het laboratorium en karakteriseerden ze hun biochemische eigenschappen.
Ze ontdekten dat de oudste kinasen (ongeveer 1,5 miljard jaar oud) al autofosforylering gebruiken voor hun regulatie. Dit is vanuit evolutionair oogpunt logisch, aangezien het proces alleen zijn eigen katalytische machinerie nodig heeft.
De meer geavanceerde allosterische regulering, via binding aan een tweede eiwit, begint ongeveer 1 miljard jaar geleden met het optreden van die partner, TPX2.
Opvallend, ontdekten de wetenschappers dat, in tegenstelling tot de algemene opvatting, er is geen co-evolutie - wederkerige veranderingen in beide partners langs het evolutionaire traject - maar dat eerder de hele interfase van hun interactie constant blijft gedurende 1 miljard jaar. Met andere woorden, ze ontdekten dat co-conservering een extreem sterke evolutionaire beperking was.
Maar wat gebeurde er met allosterische activering? Deze geavanceerde regulatie evolueert geleidelijk over 1 miljard jaar, wat leidt tot de sterkste allosterische activering in ons menselijk kinase. De onderzoekers ontdekten dat het mechanisme ervan de evolutie is van een geavanceerd allosterisch netwerk dat het hele kinase overspant vanaf de plaats van de TPX2-binding tot de andere kant van het eiwit.
De bevindingen van Kern hebben verstrekkende implicaties voor het begrijpen van de evolutie van complexiteit van extreem primitieve wezens tot de menselijke soort, en voor nieuwe benaderingen van kankertherapie die profiteren van de nieuw ontdekte allosterische netwerken in onze moderne eiwitten.
 Onderzoeksteam brengt nieuwe wereldwijde grondwaterkaarten uit
Onderzoeksteam brengt nieuwe wereldwijde grondwaterkaarten uit Techniek om afzonderlijke bacteriën in een gemengde cultuur te scheiden
Techniek om afzonderlijke bacteriën in een gemengde cultuur te scheiden De betekenis van milieuwoorden is belangrijk in het tijdperk van nepnieuws
De betekenis van milieuwoorden is belangrijk in het tijdperk van nepnieuws 33-jarige studie toont toenemende oceaanwinden en golfhoogten aan
33-jarige studie toont toenemende oceaanwinden en golfhoogten aan Mars-wetenschappers onderzoeken het oude leven in Australië
Mars-wetenschappers onderzoeken het oude leven in Australië
Hoofdlijnen
- Foster-kikkervisjes triggeren het ouderlijk instinct bij gifkikkers
- Vissen geven inzicht in de evolutie van het immuunsysteem
- Wat is de neurochemie van geluk?
- Wetenschappers stellen universele wetten voor over de grootte en biologie van plantenzaden
- Dit is waarschijnlijk waarom je een geest hebt gezien, volgens Science
- Zooplankton Vs. fytoplankton
- Hoe verschillende mierensoorten in hetzelfde territorium naast elkaar bestaan
- Hoe kunnen kinderen van dezelfde ouders er zo verschillend uitzien?
- Hoe overleef je een massale uitsterving?
- Wetenschappers creëren op een eenvoudige manier onmogelijke materialen
- Supersnelle methode voor keramische productie zou de deur kunnen openen naar AI-gestuurde materiaalontdekking

- Nieuwe antivirale, antibacterieel oppervlak kan de verspreiding van infecties in ziekenhuizen verminderen

- Onderzoek naar een thermische uitdaging voor MOF's

- Voorbehandelen van hinderlijke groenalgen met loog, ureum verhoogt bacteriële productie van biogas

 Kolenafhankelijk Polen om de industrie te compenseren voor koolstofkosten
Kolenafhankelijk Polen om de industrie te compenseren voor koolstofkosten De consumptie van thuiswijn is aanzienlijk toegenomen tijdens de opsluiting
De consumptie van thuiswijn is aanzienlijk toegenomen tijdens de opsluiting PlayStation VR-verzameling:Stardust Odyssey, Audica hoogtepunt vakantie-aanbod
PlayStation VR-verzameling:Stardust Odyssey, Audica hoogtepunt vakantie-aanbod Battle Epic:Wanneer orkanen botsen met vulkanen
Battle Epic:Wanneer orkanen botsen met vulkanen  Nanodeeltjes kunnen thuiskoeling toegankelijker maken voor huishoudens met een laag inkomen
Nanodeeltjes kunnen thuiskoeling toegankelijker maken voor huishoudens met een laag inkomen Nieuwe technologie zet afvalplastic in een uur om in vliegtuigbrandstof
Nieuwe technologie zet afvalplastic in een uur om in vliegtuigbrandstof Nieuwe aanwijzingen over donkere materie uit de donkerste sterrenstelsels
Nieuwe aanwijzingen over donkere materie uit de donkerste sterrenstelsels Hoge-orde synthetische afmetingen in fotonische roosters van golfgeleiders
Hoge-orde synthetische afmetingen in fotonische roosters van golfgeleiders
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

