Wetenschap
Biochemici vangen en visualiseren een enzym wanneer het actief wordt
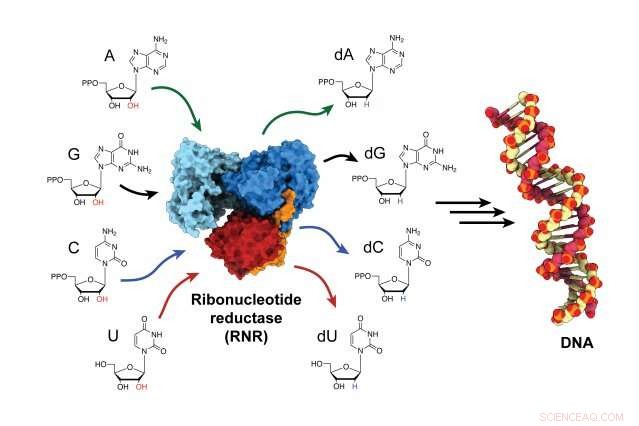
Het ribonucleotide-reductase (RNR)-enzym is verantwoordelijk voor het omzetten van RNA-bouwstenen in DNA-bouwstenen, en is een cruciale speler in zowel de synthese als het herstel van DNA in alle organismen. Krediet:Gyunghoon "Kenny" Kango
Hoe leg je een cellulair proces vast dat zich in een oogwenk voltrekt? Biochemici van het MIT hebben een manier bedacht om een vitaal enzym te vangen en te visualiseren op het moment dat het actief wordt. Dit geeft informatie over de ontwikkeling van geneesmiddelen en onthult hoe biologische systemen energie opslaan en overdragen.
Het enzym, ribonucleotidereductase (RNR), is verantwoordelijk voor het omzetten van RNA-bouwstenen in DNA-bouwstenen, om nieuwe DNA-strengen te bouwen en oude te repareren. RNR is een doelwit voor antikankertherapieën, evenals medicijnen die virale ziekten zoals HIV / AIDS behandelen. Maar decennia lang wetenschappers hadden moeite om te bepalen hoe het enzym wordt geactiveerd omdat het zo snel gebeurt. Nutsvoorzieningen, Voor de eerste keer, onderzoekers hebben het enzym in zijn actieve staat gevangen en waargenomen hoe het enzym van vorm verandert, de twee subeenheden dichter bij elkaar brengen en de energie overbrengen die nodig is om de bouwstenen voor DNA-assemblage te produceren.
Voorafgaand aan deze studie, velen geloofden dat de twee subeenheden van RNR bij elkaar kwamen en perfect symmetrisch waren, als een sleutel in een slot. "Al 30 jaar dat dachten we, " zegt Catherine Drennan, een MIT-professor scheikunde en biologie en een onderzoeker van het Howard Hughes Medical Institute. "Maar nu, we kunnen zien dat de beweging veel eleganter is. Het enzym voert eigenlijk een 'moleculaire square dance' uit, ' waar verschillende delen van het eiwit aan vasthaken en rond andere delen slingeren. Het is echt heel mooi."
Drennan en Joanne Stubbe, emeritus hoogleraar scheikunde en biologie aan het MIT, zijn de senior auteurs van de studie, die in het tijdschrift verscheen Wetenschap op 26 maart. Voormalig afgestudeerde student Gyunghoon "Kenny" Kang Ph.D. '19 is de hoofdauteur.
alle eiwitten, inclusief RNR, zijn samengesteld uit fundamentele eenheden die bekend staan als aminozuren. Al meer dan een decennium, Stubbe's lab heeft geëxperimenteerd met het vervangen van de natuurlijke aminozuren van RNR door synthetische. Daarbij, het lab realiseerde zich dat ze het enzym in zijn actieve toestand konden vangen en de terugkeer naar normaal konden vertragen. Echter, het was pas toen het Drennan-lab toegang kreeg tot een belangrijke technologische vooruitgang - cryo-elektronenmicroscopie - dat ze hoge resolutiebeelden van deze "gevangen" enzymen uit het Stubbe-lab konden maken en van dichterbij konden bekijken.
"We hadden echt geen cryo-elektronenmicroscopie gedaan op het moment dat we actief begonnen te proberen het onmogelijke te doen:de structuur van RNR in zijn actieve staat krijgen, " zegt Drennan. "Ik kan niet geloven dat het werkte; Ik knijp mezelf nog steeds."
Door de combinatie van deze technieken kon het team de complexe moleculaire dans visualiseren waarmee het enzym de katalytische "vuurkracht" van de ene subeenheid naar de volgende kan transporteren. om DNA-bouwstenen te genereren. Deze vuurkracht is afgeleid van een zeer reactief ongepaard elektron (een radicaal), die zorgvuldig moeten worden gecontroleerd om schade aan het enzym te voorkomen.
Volgens Drennan, het team "wilde zien hoe RNR het equivalent doet van spelen met vuur zonder verbrand te worden."
Eerste auteur Kang zegt dat het vertragen van de radicale overdracht hen in staat stelde delen van het enzym te observeren die niemand eerder volledig had kunnen zien. "Vóór deze studie, we wisten dat deze moleculaire dans plaatsvond, maar we hadden de dans nog nooit in actie gezien, "zegt hij. "Maar nu we een structuur hebben voor RNR in zijn actieve staat, we hebben een veel beter idee over hoe de verschillende componenten van het enzym bewegen en op elkaar inwerken om het radicaal over lange afstanden over te brengen."
Hoewel deze moleculaire dans de subeenheden samenbrengt, er is nog steeds een aanzienlijke afstand tussen hen:de radicaal moet 35-40 angstrom reizen van de eerste subeenheid naar de tweede. Deze reis is ongeveer 10 keer verder dan de gemiddelde radicale overdracht, volgens Drennan. Het radicaal moet dan terugreizen naar zijn startplaats en veilig worden opgeborgen, allemaal binnen een fractie van een seconde voordat het enzym terugkeert naar zijn normale conformatie.
Omdat RNR een doelwit is voor geneesmiddelen die kanker en bepaalde virussen behandelen, het kennen van de actieve-toestandstructuur zou onderzoekers kunnen helpen om effectievere behandelingen te bedenken. Inzicht in de actieve toestand van het enzym kan ook inzicht geven in biologisch elektronentransport voor toepassingen zoals biobrandstoffen. Drennan en Kang hopen dat hun onderzoek anderen zal aanmoedigen om vluchtige cellulaire gebeurtenissen vast te leggen die in het verleden moeilijk waarneembaar waren.
"Misschien moeten we tientallen jaren van resultaten uit het verleden opnieuw beoordelen, " zegt Drennan. "Deze studie zou meer vragen kunnen oproepen dan beantwoorden; het is meer een begin dan een einde."
Dit verhaal is opnieuw gepubliceerd met dank aan MIT News (web.mit.edu/newsoffice/), een populaire site met nieuws over MIT-onderzoek, innovatie en onderwijs.
 Afbeelding:Lake George, Oeganda
Afbeelding:Lake George, Oeganda Voeg gewoon vochtigheid toe:hoe deze lucht-naar-watermachine je dorst kan lessen
Voeg gewoon vochtigheid toe:hoe deze lucht-naar-watermachine je dorst kan lessen De natuurlijke aerosolfabriek in de Himalaya kan het klimaat beïnvloeden
De natuurlijke aerosolfabriek in de Himalaya kan het klimaat beïnvloeden Bossen herstellen met 1 boom tegelijk, om het klimaat te helpen herstellen
Bossen herstellen met 1 boom tegelijk, om het klimaat te helpen herstellen Wat is de levensduur van vulkanische eilanden zoals Hawaï en de Galapagos?
Wat is de levensduur van vulkanische eilanden zoals Hawaï en de Galapagos?
Hoofdlijnen
- De structurele stabiliteit van de DNA-dubbele helix
- Welke cellen kunnen door het menselijk oog worden gezien?
- Welke cellen zou je gebruiken om DNA van een levende persoon te extraheren?
- Teams Advance maakt het bewerken van genen met chirurgische precisie mogelijk
- De geleidbaarheid van zenuwcellen in het centrale zenuwstelsel
- Staan we aan het begin van het einde van de westerse beschaving?
- Gevild karkas van zeeotter gevonden op strand in Californië
- Niveaus van celorganisatie
- Wanneer stopt het leven op aarde?
 Waarom het redden van onze blauwe planeet in de handen ligt van burgerwetenschappers
Waarom het redden van onze blauwe planeet in de handen ligt van burgerwetenschappers "IB Group 4 Project Ideas
"IB Group 4 Project Ideas Sommige lemuren zijn eenlingen, anderen hunkeren naar verbinding
Sommige lemuren zijn eenlingen, anderen hunkeren naar verbinding Synthetische receptoren kunnen celfuncties opnieuw bedraden en bijwerkingen minimaliseren
Synthetische receptoren kunnen celfuncties opnieuw bedraden en bijwerkingen minimaliseren Food Coloring & Science Projects
Food Coloring & Science Projects  De oceaan wordt stabieler:waarom is dat misschien geen goede zaak?
De oceaan wordt stabieler:waarom is dat misschien geen goede zaak? Zijn zinkende bodems in de Everglades gerelateerd aan klimaatverandering?
Zijn zinkende bodems in de Everglades gerelateerd aan klimaatverandering? Op zoek naar onzichtbare axion donkere materie met een nieuwe meercellige haloscoop
Op zoek naar onzichtbare axion donkere materie met een nieuwe meercellige haloscoop
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com