
Wetenschap
Spinzijde:een kneedbaar eiwit zorgt voor versterking

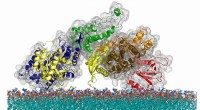
De figuur toont een spinnenweb samen met de moleculaire structuur van het onderzochte domein in de gebonden toestand in oppervlakterepresentatie (structuur in rood/oranje, linker bovenhoek). De zijketens van het aminozuur methionine, die zich in de kern van het domein bevinden waar ze dienen om de structuur te kneedbaar maken, zijn gemarkeerd als gekleurde stokken. Krediet:Pixaby.com / Collage:Hannes Neuweiler
Waarom zijn de lichtgewicht zijden draden van webspinnen sterker dan de meeste andere materialen? Wetenschappers van de universiteiten van Würzburg en Mainz werkten samen om antwoorden op deze vraag te vinden. Ze konden aantonen dat het natuurlijke aminozuur methionine plasticiteit geeft aan een eiwitdomein, dat een constitutief onderdeel is van spinnenzijde. Deze plasticiteit verhoogt de sterkte van de binding tussen de afzonderlijke domeinen aanzienlijk. De wetenschappers hebben hun bevindingen gepubliceerd in het huidige nummer van Natuurcommunicatie .
Materiaal met vele toepassingen
De studie wordt geleid door Dr. Hannes Neuweiler, een docent en groepsleider bij de afdeling Biotechnologie en Biofysica van de Universiteit van Würzburg. Hij bestudeert al vele jaren spinnenzijde-eiwitten, of beter gezegd hun moleculaire eigenschappen. "Spinnenzijde is een van de taaiste materialen die in de natuur worden gevonden. Het is sterker in gewicht dan hightechvezels zoals Kevlar of koolstof, ", zegt Neuweiler. De unieke combinatie van taaiheid en elasticiteit maakt het zeer aantrekkelijk voor de industrie. Of het nu in de luchtvaart, de textielindustrie of de geneeskunde, potentiële toepassingen van dit uitstekende materiaal zijn talrijk.
Hoewel synthetische spinzijde al op industriële schaal wordt geproduceerd en in verschillende producten wordt gebruikt, het is nog niet in staat om de uitstekende mechanische eigenschappen van de natuurlijke blauwdruk na te bootsen. De nieuwste bevindingen van de onderzoekers in Würzburg kunnen bijdragen aan het wegwerken van de tekortkomingen.
Een ondergewaardeerd aminozuur
"We hebben ontdekt dat webspinnen gebruik maken van een bepaald aminozuur, methionine genoemd, om zijde-eiwitten op een voorheen onbekende manier stevig met elkaar te verbinden, Neuweiler schetst het centrale resultaat van het onderzoek. Op de achtergrond:Al het leven is gebaseerd op eiwitten. De natuur put uit een beperkte set van 20 verschillende aminozuren om alle eiwitten op te bouwen, die kritisch deelnemen aan bijna elke taak van een levend organisme. Na te zijn gesynthetiseerd als lineaire ketens van aminozuren, de meeste eiwitten vouwen in zeer geordende, driedimensionale structuren.
Natuurlijke aminozuren kunnen grofweg in twee groepen worden verdeeld op basis van de eigenschappen van hun zijketens. Zogenaamde hydrofobe zijketens hebben een lage oplosbaarheid in water. Ze bevinden zich vaak in de kern van een eiwit en stabiliseren de gevouwen toestand. hydrofiel, of in water oplosbaar, zijketens bevinden zich meestal op het oppervlak van het eiwit, waar ze verantwoordelijk zijn voor een bijna onbeperkte verscheidenheid aan functies. Methionine behoort tot de groep van hydrofobe aminozuren. Maar het is zeldzaam in de meeste eiwitten. "Daten, moleculair biologen en eiwitwetenschappers hebben weinig aandacht besteed aan dit aminozuur. In eiwitten wordt aangenomen dat de zijketen van methionine weinig functioneel belang heeft, ' zegt Neuweiler.
Aanzienlijke verbetering van de functie
Deze mening kan nu veranderen. Het is bekend dat de zijketen van methionine uitzonderlijk flexibel is in vergelijking met de zijketens van de andere 19 natuurlijke aminozuren. Neuweiler en zijn team konden nu aantonen dat spinnen deze eigenschap benutten door grote hoeveelheden methionine in de kern van de aminoterminale domeinen van hun zijde-eiwitten te plaatsen. Hier draagt het aminozuur zijn flexibiliteit over aan de hele structuur van het domein, waardoor het taai wordt.
Eiwitten worden traditioneel gezien als starre lichamen. Meer recent onderzoek, echter, benadrukt het belang van eiwitdynamica voor hun functie. "Als een vormbare sleutel die zijn vorm aanpast aan het slot, de domeinen van de zijde-eiwitten veranderen van vorm om nauw met elkaar te verbinden, " Neuweiler beschrijft het proces. Dit effect verbetert de bindingssterkte tussen de terminale domeinen aanzienlijk. Methionine in de hydrofobe kern van een eiwit kneedt de structuur, die de functie drastisch kan verbeteren.
Van fundamenteel onderzoek tot toegepaste wetenschap
Dr. Neuweiler en zijn collega's doen fundamenteel onderzoek in hun laboratoria. "Ons werk is erop gericht fundamentele bijdragen te leveren aan het begrijpen van de relatie tussen structuur, dynamiek en functie van eiwitten, " zegt de wetenschapper. Tegelijkertijd hij verwacht dat deze nieuwe bevindingen implicaties zullen hebben op het gebied van ontwerp en ontwikkeling van nieuwe eiwitten en in de materiaalwetenschap.
Hij denkt dat het denkbaar is om methionine op te nemen in de kern van eiwitten, zoals webspinnen doen, om hun functies te verbeteren of zelfs nieuwe functies te creëren. Volgens Neuweiler materiaalwetenschap zal waarschijnlijk profiteren van de ontdekking dat methionine in zijde-eiwitten nauwe interacties in spinzijde veroorzaakt. Door het methioninegehalte van zijdeproteïnedomeinen kunstmatig te wijzigen, het kan mogelijk zijn om de mechanische eigenschappen van de kunststof te controleren.
Neuweiler en zijn team zijn van plan vergelijkende studies te doen naar het effect van methionine in zijde-eiwitten van andere spinsoorten en zijdeklieren. Bovendien, ze willen methionine opnemen in eiwitten van andere organismen om hun functies te wijzigen en mogelijk te verbeteren.
 The Difference Between Dolphin Fish & Dolphin Mammal
The Difference Between Dolphin Fish & Dolphin Mammal  Binnenlucht op scholen kan bijdragen aan de blootstelling van kinderen aan PCB's
Binnenlucht op scholen kan bijdragen aan de blootstelling van kinderen aan PCB's Onderzoeksmodellen presenteren regenvalgegevens om toekomstige voorspellingen te verbeteren van hoe extreem weer het stadsleven zal beïnvloeden
Onderzoeksmodellen presenteren regenvalgegevens om toekomstige voorspellingen te verbeteren van hoe extreem weer het stadsleven zal beïnvloeden Bedrijfsgeheim over klimaatverandering als doelwit van Washington en Californië
Bedrijfsgeheim over klimaatverandering als doelwit van Washington en Californië The Greenhouse Effect & Photosynthesis
The Greenhouse Effect & Photosynthesis
Hoofdlijnen
- Studie onderzoekt obesitas en reproductieve status van dierentuinolifanten
- Celmodellen voor wetenschapsprojecten
- Droogteresistente plantengenen kunnen de evolutie van waterbesparende gewassen versnellen
- Hoe een celvorm zijn functie beïnvloedt
- Dikke eekhoorn steelt dure goederen die zijn achtergelaten voor bezorgers
- Wat is de relatie tussen genetische manipulatie en DNA-technologie?
- Puget Sound-walvissen krijgen gratis een pauze van watersporters om walvissen te spotten
- Nieuwsgierige grote witte haai speelt met camera
- De natuur laat zien hoe bacteriën lignine afbreken en geeft beter inzicht om biobrandstoffen te maken
- Ingenieurs maken een eenvoudige test die stresshormonen in zweet kan meten, bloed, urine of speeksel

- Prominente academici pleiten voor meer wetenschap in forensische wetenschap

- Baanbrekende studie van celsignalering belooft veel voor immuunonderzoek en daarbuiten
- Effect van menselijke activiteiten op het milieu

- Kunstmatige receptor maakt onderscheid tussen mannelijke en vrouwelijke hormonen

 Kennis van de oorsprong van het voedsel maakt het beter smaken
Kennis van de oorsprong van het voedsel maakt het beter smaken Nieuwe geminiaturiseerde hyperspectrale camera's om de gezondheid van Australische landschappen te bewaken
Nieuwe geminiaturiseerde hyperspectrale camera's om de gezondheid van Australische landschappen te bewaken Ingenieurs maken een eenvoudige test die stresshormonen in zweet kan meten, bloed, urine of speeksel
Ingenieurs maken een eenvoudige test die stresshormonen in zweet kan meten, bloed, urine of speeksel Weerzinwekkende markten zetten aan tot nadenken over het engineeren van complexe systemen
Weerzinwekkende markten zetten aan tot nadenken over het engineeren van complexe systemen Tot ziens, stokbrood! Frankrijk wordt gek van le burger
Tot ziens, stokbrood! Frankrijk wordt gek van le burger Antarctische ijsscheur nabij afkalven, na een groei van 17 km in 6 dagen
Antarctische ijsscheur nabij afkalven, na een groei van 17 km in 6 dagen Deep learning geeft medicijnontwerp een boost
Deep learning geeft medicijnontwerp een boost Italië zindert als Spanje, Portugal zet zich schrap voor komende hittegolf
Italië zindert als Spanje, Portugal zet zich schrap voor komende hittegolf
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

