
Wetenschap
Baanbrekende studie van celsignalering belooft veel voor immuunonderzoek en daarbuiten
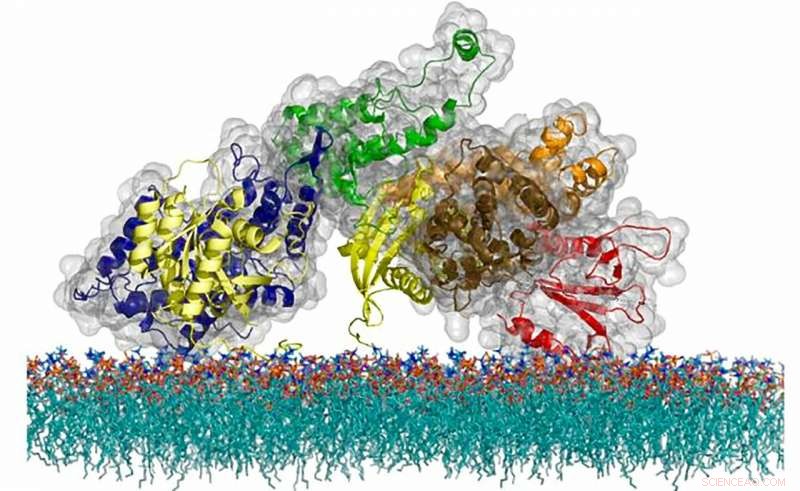
De atomaire structuur van het SOS-eiwit, een cel-berichtenmolecuul dat een uniek timingmechanisme gebruikt om de activering van een kritieke immuunsysteemroute te reguleren. Krediet:Steven Alvarez/Berkeley Lab
Voor de eerste keer ooit, wetenschappers hebben het proces in beeld gebracht waarbij een individueel immuunsysteemmolecuul wordt ingeschakeld als reactie op een signaal uit de omgeving, wat leidde tot de cruciale ontdekking dat het activeringsproces gepaard gaat met honderden eiwitten die plotseling samenkomen om een gekoppeld netwerk te vormen via een proces dat bekend staat als een faseovergang.
Het nieuwe werk, beschreven in een recent gepubliceerd artikel in Wetenschap , biedt een enorme sprong voorwaarts in ons begrip van hoe het immuunsysteem nauwkeurig is afgestemd om zelfs maar een enkel virusmolecuul te detecteren te midden van een zee van miljoenen andere moleculen, waardoor we snel kunnen herstellen van virale infecties zoals griep. Door te leren hoe deze specifieke eiwitten werken, wetenschappers zullen ook beter begrijpen waarom hun activiteit soms misgaat - gebeurtenissen die kunnen leiden tot auto-immuunziekten, zoals diabetes of reumatoïde artritis – en kan unieke inzichten verschaffen over hoe het eigen immuunsysteem van een kankerpatiënt kan worden aangestuurd om kanker te genezen.
"Dit is iets dat gebeurt in een levende cel tijdens het proces van het nemen van een beslissing door de cel - signaaltransductie is wat we het noemen - en het is hoe cellen 'denken' met chemische reacties, " zei studieleider Jay Groves, een faculteitschemicus in de Biosciences Area van het Lawrence Berkeley National Laboratory van het Department of Energy (Berkeley Lab). "Op het gebied van de biologie als geheel, het idee van een eiwitcondensatiefaseovergang heeft de laatste tijd veel aandacht gekregen. Veel groepen over de hele wereld bestuderen deze verschijnselen, maar tot nu toe, niemand wist hoe of waarom de cel ze gebruikt.
"Onze krant is Ik geloof, de eerste die direct test en bevestigt hoe een faseovergang signalering kan reguleren, Groves zei. "En de grote ontdekking is dat het een moleculair timingmechanisme is. De cel gebruikt de tijd om een echte receptorstimulatie te onderscheiden van chemische achtergrondruis."
Een essentiële celboodschapper bestuderen
De onthulling van het team kwam tot stand als onderdeel van het lopende onderzoek door het Groves-lab naar de fysieke mechanismen van T-celsignalering en het Ras-eiwit. Gevonden in alle eukaryote cellen in meerdere variaties, Ras draagt veel hoeden, waaronder optreden als een regulator voor celgroei, afdeling, en dood. T-cellen, de cellen van het immuunsysteem die vreemde en mogelijk schadelijke infecties detecteren, gebruik Ras als een aan-uit-schakelaar voor het indringerwaarschuwingspad dat een beschermende reactie lanceert. Het vermogen van de T-cel om een echt extern signaal te onderscheiden - wanneer een vreemd molecuul zich bindt met de toepasselijk genaamde T-celreceptor (TCR) op het celoppervlak - van onbedoeld contact met nabijgelegen eiwitten is van cruciaal belang voor een functionerend immuunsysteem. Als een T-cel per ongeluk reageert op een van onze eigen moleculen, dan kan een auto-immuunziekte ontstaan. Tegelijkertijd, als een T-cel zijn gevoeligheid verliest, dan kunnen virussen ongecontroleerd groeien en worden kankercellen niet uit het lichaam verwijderd.
Vanwege de grote gevolgen voor de menselijke gezondheid, wetenschappers hebben zich lang afgevraagd hoe de cellen hun signalen reguleren om dit evenwicht te bereiken. Eerder onderzoek had aangetoond dat de Ras-eiwitten van een T-cel niet rechtstreeks interageren met celreceptoren. In plaats daarvan, receptoren sturen het "aan"-signaal naar interne intermediaire eiwitten, waaronder een sleutelgroep van drie eiwitten, bekend als LAT, Grb2, en SOS, die uiteindelijk het signaal doorgeven aan Ras. Voorafgaand aan deze studie, wetenschappers wisten dat dit moleculaire trio aan elkaar kon koppelen in een faseovergangsproces, maar niemand wist wat de faseovergang deed. En tot voor kort, het was onmogelijk om erachter te komen, omdat er geen technologie was waarmee wetenschappers de activiteit van individuele moleculen in complexe celmembraansystemen direct konden volgen.
Het onderzoeksteam nam deze hindernis weg door een aanpak uit te vinden op basis van ondersteunde membraanmicroarrays, een technologie die het team al vele jaren aan het ontwikkelen is, waarbij gebruik wordt gemaakt van steigers gemaakt van nano-gefabriceerde structuren om celmembranen vast te houden.
Faseovergangen op het werk
In de huidige studie, de wetenschappers gebruikten microscopie om te kijken naar het moment dat een T-celreceptor op een ondersteunde membraanmicroarray een enkel SOS-molecuul vroeg om te activeren. In plaats van meteen te reageren, SOS wachtte 10 tot 30 seconden voordat het naar de actieve status ging. Als de nabijgelegen LAT- en Grb2-moleculen de faseovergang met SOS ondergingen, en gecondenseerd in hun geassembleerde staat, ze konden SOS lang genoeg op het membraan houden om SOS te activeren. Zonder faseovergang de lange vertraging in het SOS-molecuul zou voorkomen dat het wordt geactiveerd voordat het de receptor verlaat.
"Het is alsof het eiwit een vertraging heeft ingebouwd, " legde Groves uit. "Het heeft de faseovergang nodig in combinatie met aanhoudende signalering, en alleen dan zal het aangaan."
Hoewel dit onderzoek specifiek was voor T-celsignalering, Groves en zijn collega's zijn van mening dat vergelijkbare timingmechanismen voor faseovergang waarschijnlijk betrokken zijn bij een verscheidenheid aan andere celreacties. Nu ze een bewezen experimentele techniek hebben ontwikkeld om de moleculaire activering van dergelijke processen te observeren, het team hoopt meer langdurige mysteries te ontrafelen over hoe cellen zoveel complexe taken uitvoeren.
 Hoe u een eindtemperatuur berekent
Hoe u een eindtemperatuur berekent Nieuwe theorieën en materialen helpen de overgang naar schone energie
Nieuwe theorieën en materialen helpen de overgang naar schone energie Chemici kunnen uniforme chiraliteit induceren
Chemici kunnen uniforme chiraliteit induceren Wetenschappers houden vast aan spinzijde als biologisch afbreekbaar alternatief voor traditionele lijm
Wetenschappers houden vast aan spinzijde als biologisch afbreekbaar alternatief voor traditionele lijm De effecten van chloor op de watergeleidbaarheid
De effecten van chloor op de watergeleidbaarheid
 Digitale tweelingen ontwikkelen voor verbeterde orkaanvoorspelling
Digitale tweelingen ontwikkelen voor verbeterde orkaanvoorspelling Scores dood als recordbrekende hittegolf Canada in zijn greep houdt, ons
Scores dood als recordbrekende hittegolf Canada in zijn greep houdt, ons De huidige voedselproductiesystemen kunnen een ingrijpend verlies van leefgebied betekenen
De huidige voedselproductiesystemen kunnen een ingrijpend verlies van leefgebied betekenen Tibet-sedimenten onthullen klimaatpatronen uit het late Mioceen, zes miljoen jaar geleden
Tibet-sedimenten onthullen klimaatpatronen uit het late Mioceen, zes miljoen jaar geleden Wetenschappers ontdekken hoe en wanneer een ondergrondse oceaan ontstond
Wetenschappers ontdekken hoe en wanneer een ondergrondse oceaan ontstond
Hoofdlijnen
- Wat bevindt zich aan de linkerkant van uw lichaam in menselijke anatomie?
- Hoe Body Dysmorphic Disorder werkt
- Psychologische theorie over de vijf menselijke zintuigen
- De wereldwijde impact van krimpende gletsjers op ongewervelde rivieren in kaart brengen
- Wat breekt een dubbele DNA-helix uiteen?
- Difference Between Gap Junctions & Plasmodesmata
- Mariene robots detecteren walvissen in de diepe oceaan
- Gebruik van microscopen in de wetenschap
- 6 veelvoorkomende hallucinaties en wat ze ons vertellen
- Gemodificeerde biomaterialen zelf-assembleren op temperatuursignalen

- Onderzoekers realiseren 4D-geprint materiaal

- Nieuwe chemische mechanismen geïdentificeerd op weg naar schoner, efficiëntere verbranding

- Nieuwe fotonische vloeibare kristallen kunnen leiden tot displays van de volgende generatie

- Meten van kleine krachten die tot grote effecten leiden

 Ontdekking van poreuze vloeistof leidt tot nieuw spin-outbedrijf
Ontdekking van poreuze vloeistof leidt tot nieuw spin-outbedrijf Googles zoekhulpmiddel om werkzoekende veteranen te helpen
Googles zoekhulpmiddel om werkzoekende veteranen te helpen Ontdekking van nul-energie gebonden toestanden aan beide uiteinden van een eendimensionaal atoomlijndefect
Ontdekking van nul-energie gebonden toestanden aan beide uiteinden van een eendimensionaal atoomlijndefect Milliliters converteren naar gram
Milliliters converteren naar gram  Het risico op een keizersnede is erfelijk:natuurlijke selectie kan het aantal belemmerde bevallingen niet verminderen
Het risico op een keizersnede is erfelijk:natuurlijke selectie kan het aantal belemmerde bevallingen niet verminderen Observatie van skyrmionen in een ferromagneet met centrosymmetrie
Observatie van skyrmionen in een ferromagneet met centrosymmetrie Definitie van Tertiaire consument
Definitie van Tertiaire consument  Uit onderzoek blijkt dat de zorgen over de verkiezingen per ras verschillen, opleidingsniveaus, partij affiliatie
Uit onderzoek blijkt dat de zorgen over de verkiezingen per ras verschillen, opleidingsniveaus, partij affiliatie
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

