Wetenschap
Nieuwe benaderingen om de moleculaire oorzaken van amyloïdevorming te onderzoeken

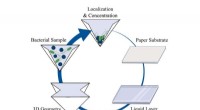
Illustratie van een groeiende fibril in de val en de laser. Krediet:Martin Fränzl
Wereldwijd lijden meer dan 24 miljoen mensen aan neurodegeneratieve ziekten zoals de ziekte van Alzheimer, Parkinson of Huntington. De moleculaire oorzaken van deze ziekten zijn tot nu toe weinig onderzocht. Een team van wetenschappers van de Universiteit van Leipzig en de Technische Universiteit van Dresden, evenals het Kurt Schwabe Instituut Meinsberg, onderzoekt nu deze moleculaire mechanismen met nieuwe benaderingen, en heeft een techniek ontwikkeld met een thermische molecuulval. De onderzoekers hebben hun bevindingen gepubliceerd in Natuurmethoden .
Onderzoekers nemen aan dat de oorzaak van deze neurodegeneratieve ziekten de aggregatie is van kleine eiwitmoleculen die peptiden worden genoemd. Peptiden voeren meestal verschillende taken uit in het lichaam met hun speciale driedimensionale structuur. Bijvoorbeeld, ze werken als hormonen, ze zijn betrokken bij het transport van stoffen door het celmembraan, en hebben antibiotische en antivirale functies. Echter, wanneer peptiden samenkomen om kleine aggregaten of zelfs grotere onoplosbare structuren te vormen die plaques of amyloïden worden genoemd, hun oorspronkelijke functie gaat verloren, en peptideaggregaten kunnen toxisch zijn.
De manier waarop individuele peptiden kleinere aggregaten en uiteindelijk fibrillen worden, is niet duidelijk en experimenteel moeilijk waar te nemen. Zelfs de groei van fibrillen is niet voldoende opgelost, aangezien bijna alle eerdere onderzoeken alleen zijn uitgevoerd voor grote hoeveelheden moleculen bestaande uit een mengsel van peptiden, aggregaten en fibrillen van verschillende groottes.
De onderzoekers hebben nieuwe verklarende benaderingen bedacht:"Bij het onderzoeken van mengsels van afzonderlijke moleculen, aggregaten en fibrillen voor hun eigenschappen, men krijgt een beeld van veel overlappende effecten. Een belangrijke stap naar een gedetailleerd begrip op moleculair niveau is het bestuderen van de groei van individuele amyloïde fibrillen, " legt Prof. Dr. Frank Cichos uit, hoofd van het project aan de Universiteit van Leipzig.
Met behulp van hun nieuw ontwikkelde thermische val, de onderzoekers vingen individuele fibrillen enkele uren op in fysiologische oplossingen onder de microscoop en voor de eerste keer, observeerde de groei van de fibril, het uiteenvallen en de verdere groei van de fragmenten. "Het ontwikkelen van een techniek voor dit doel was een lastige taak. Moleculen in vloeistoffen bewegen gestaag door de temperatuur van de vloeistof. Deze zogenaamde Brownse beweging drijft ze snel uit ons waarnemingsveld, en we kunnen individuele fibrillen slechts voor een zeer korte tijd waarnemen, " zegt Martin Fränzl, een promovendus in het project.
De onderzoekers maken nu gebruik van de thermische energie die ervoor zorgt dat de Brownse beweging de fibrillen in een klein volume opsluit. "We gebruiken een laser om een kleine metalen ring op te warmen waarbinnen de aggregaten zijn opgesloten. De resulterende temperatuurverschillen in de oplossing met de peptiden drijven ze in elke richting die we specificeren, " legt Tobias Thalheim uit, die met Martin Fränzl aan de thermische vallen werkte. Maar het vangen van de amyloïden is niet genoeg. De temperatuurgecontroleerde val stelt de wetenschappers ook in staat om de beweging van de fibrillen te volgen en wiskundig te analyseren. Met behulp van de roterende beweging van de fibrillen, ze observeerden de verandering in grootte van de fibrillen tot op een miljoenste centimeter, en zo nauwkeurig hun groeisnelheid bepaald.
"We kunnen nu processen zien die eerder werden aangenomen, maar waarvoor geen direct experimenteel bewijs was, " legt Cichos uit. Voor de groei van de fibrillen, hun breuk zou een belangrijke rol moeten spelen, omdat het het aantal vrije uiteinden verdubbelt waar de groei doorgaat. De experimenten tonen aan dat fibrillen breken en zo nieuwe spruiten vormen, waardoor de peptiden sneller aggregeren. "Er is nu een veelvoud aan nieuwe experimenten mogelijk, en we kunnen paden volgen die voorheen niet mogelijk waren, ' zegt Cichos.
Prof. Dr. Michael Mertig van de Technische Universiteit van Dresden, directeur van het Kurt Schwabe Institute for Measurement and Sensor Technology e.V. Meinsberg, voegt toe, "Tegelijkertijd, dit werk toont het enorme potentieel in de ontwikkeling van geminiaturiseerde fotonische analysesystemen voor medische diagnostiek."
 Uitleg van het concept van elektronegativiteit
Uitleg van het concept van elektronegativiteit Chemici bereiken doorbraak in de productie van driedimensionale moleculaire structuren
Chemici bereiken doorbraak in de productie van driedimensionale moleculaire structuren Hoe seleniumverbindingen katalysatoren kunnen worden
Hoe seleniumverbindingen katalysatoren kunnen worden Snelle meting van aërosolvluchtigheid met behulp van een op deep learning gebaseerde draagbare microscoop
Snelle meting van aërosolvluchtigheid met behulp van een op deep learning gebaseerde draagbare microscoop Hoe beïnvloedt concentratie de reactiesnelheid?
Hoe beïnvloedt concentratie de reactiesnelheid?
Verhogen van de concentratie van reactanten verhoogt in het algemeen de reactiesnelheid omdat meer van de reagerende moleculen of ionen aanwezig zijn om de reactieproducten te vormen. Dit is vooral
 De effecten van Platypus Venom
De effecten van Platypus Venom  Zwaveldioxideconcentraties dalen boven India tijdens COVID-19
Zwaveldioxideconcentraties dalen boven India tijdens COVID-19 Onderzoek ondersteunt de zorgen van demonstranten over de toekomst van Llobregat Delta
Onderzoek ondersteunt de zorgen van demonstranten over de toekomst van Llobregat Delta Nieuwe textuur van stikstofmeststof kan nitraatniveaus verlagen, water veiliger maken
Nieuwe textuur van stikstofmeststof kan nitraatniveaus verlagen, water veiliger maken Hoe zonne-energie de atmosfeer van de aarde beïnvloedt
Hoe zonne-energie de atmosfeer van de aarde beïnvloedt
Hoofdlijnen
- Effecten van mobiele telefoons op studenten
- Wat is een gen,
- Wat is celcompartimentering en waarom gebeurt het?
- Wat gebeurt er met cellen als gevolg van een natriumonbalans?
- Celmotiliteit: wat is het? & Waarom is het belangrijk?
- Waarom vallen mensen steeds uit?
- Waarom is UV-licht schadelijk?
- Muizen in sociale conflicten vertonen gedrag dat zich aan regels houdt
- Koloniekenmerken van E.Coli
 Laten we die buitenaardse wezens eens zien:1,3 miljoen mensen beloven de geheime Amerikaanse basis te bestormen
Laten we die buitenaardse wezens eens zien:1,3 miljoen mensen beloven de geheime Amerikaanse basis te bestormen Behoud voldoet aan moratorium op diepzeemijnbouw
Behoud voldoet aan moratorium op diepzeemijnbouw Wat zijn de twee soorten verwering?
Wat zijn de twee soorten verwering?  Zombiestorm Leslie raast Portugal binnen
Zombiestorm Leslie raast Portugal binnen Duurzaamheid van nieuw creosootalternatief bevestigd
Duurzaamheid van nieuw creosootalternatief bevestigd Staatsprocureurs-generaal werken samen aan antitrustonderzoeken van Facebook en Google
Staatsprocureurs-generaal werken samen aan antitrustonderzoeken van Facebook en Google Kleine antennes veelbelovend in defensiesector
Kleine antennes veelbelovend in defensiesector Zout meer, vijvers borrelen mogelijk onder de zuidpool van Mars
Zout meer, vijvers borrelen mogelijk onder de zuidpool van Mars
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com