
Wetenschap
De pH van calciumionen regelt de opening van het ionkanaal
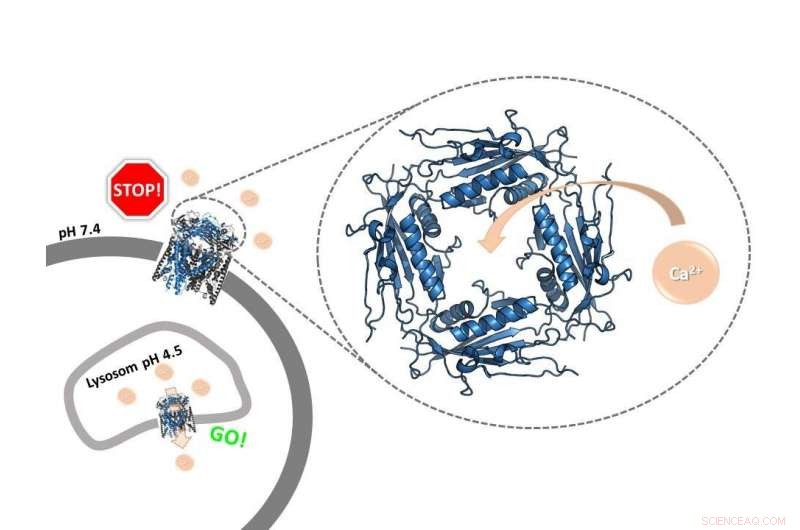
Een portierring:het extracytosolische / lumenale domein van het menselijke TRPML2-ionkanaal, wiens structuur de huidige studie voor het eerst ophelderde, functioneert als een pH-afhankelijke calciumregelaar. Het regelt de functie van het kanaal in verschillende celcompartimenten. Krediet:Kerstin K. Viet
Ionenkanalen zijn poriën in het membraan van cellen of celorganellen. Ze laten positief of negatief geladen deeltjes toe, zogenaamde ionen, over het membraan te transporteren. Biochemici van de Johannes Gutenberg University Mainz (JGU) zijn er nu in geslaagd om een belangrijk regulerend gebied van het menselijke TRPML2-calciumionkanaal met hoge resolutie in beeld te brengen. een gebied van het kanaal in de vorm van een grote ring aan één kant van het membraan. Deze ring werkt als een portier, beslissen of ionen door het kanaal kunnen bewegen. "Onze studie heeft de structuur van de ring onthuld, dat ook wel het extracytosolische/lumenale domein (ELD) wordt genoemd, in menselijke TRPML2-kanalen, en ook dat het dit domein is dat verantwoordelijk is voor de interactie van het kanaal met calcium, " zei professor Ute Hellmich van het JGU Institute of Pharmacy and Biochemistry-Therapeutical Life Sciences. Afhankelijk van de pH-waarde, de calciumionen kunnen het kanaal openen of blokkeren, en daardoor hun transport over celmembranen regelen.
De onderzoeksgroep van Hellmich onderzocht welke structurele eigenschappen van de ionkanaalring verantwoordelijk zijn voor het doorlaten van calciumionen. "Calcium is een belangrijke cellulaire boodschapper die ook een rol speelt bij veel ziekten, " legde Hellmich uit. Het element voert tal van taken in het lichaam uit, inclusief het reguleren van enzymen en het helpen bij membraanfusie.
TRPML2, afkorting voor transient receptor potential mucolipin 2, is een ionkanaal van de mucolipine-subfamilie van TRP-kanalen die betrokken zijn bij zintuiglijke waarneming bij mensen. TRPML2 speelt een rol bij de immuunrespons op infecties en verhoogt de besmettelijkheid van Zika- en dengue-virussen. In aanvulling, mutaties in TRPML-ionkanalen kunnen leiden tot blindheid, doofheid, en neurologische schade bij mensen.
De pH-waarde is cruciaal voor de activiteit van ionenkanalen
Zoals Hellmich duidelijk maakt, ionenkanalen zijn geen simpele gaten. Ze kunnen actief worden geopend en gesloten. Dit, beurtelings, activeert en controleert cellulaire paden. "We hebben nu ontdekt dat de binding van calcium aan het extracytosolische/lumenale domein van TRPML2 bovenop het kanaal afhankelijk is van de pH, " verklaarde Kerstin Viet, eerste auteur van het artikel in het wetenschappelijke tijdschrift Structuur . Dit onderzoek maakte deel uit van haar masterscriptie en leverde haar de Adolf Todt Foundation Prize op.
Bij een hogere pH-waarde van ongeveer zeven, aan de buitenkant van de cel, de calciumionen kunnen aan de ring binden en deze zo blokkeren. Omgekeerd, de calciumionen zijn niet langer in staat de opening te blokkeren bij een lagere pH die typisch is voor bepaalde intracellulaire compartimenten. "De ring fungeert als een poortwachter voor de rest van het ionenkanaal, ' zei Viet.
Dit regelt dus de activiteit van het kanaal:het is belangrijk dat het ionenkanaal alleen binnen de cel wordt geactiveerd, waar de pH over het algemeen laag is; in feite wordt het kanaal alleen geopend wanneer een bepaald cellulair mechanisme aangeeft dat het calcium nodig heeft. Ongevraagde activering op het celoppervlak zou wel eens kunnen leiden tot schade aan de cel. "Het regelmechanisme is slim. Het is ook relevant, bijvoorbeeld, hoe de cel reageert op een virale infectie, " zei Hellmich, eraan toevoegend dat het hele proces wanneer en hoe een ionenkanaal wordt geopend of gesloten, nog niet volledig wordt begrepen. De andere twee ionkanalen van de humane mucolipine-subfamilie, TRPML1 en TRPML3, hebben ook een soortgelijke portierring. De resultaten van het onderzoek maken het daarom voor het eerst mogelijk om alle drie de subtypes met elkaar te vergelijken.
 Omkering versnelt creatie van belangrijk molecuul:Lab maakt synthese van halichondrine B efficiënter
Omkering versnelt creatie van belangrijk molecuul:Lab maakt synthese van halichondrine B efficiënter Hoe het massagetal te vinden
Hoe het massagetal te vinden  Door bacteriële enzymen te kopiëren, lab leert snel nieuwe klasse antibiotica moleculen schoon te synthetiseren, efficiënt
Door bacteriële enzymen te kopiëren, lab leert snel nieuwe klasse antibiotica moleculen schoon te synthetiseren, efficiënt Hoeveel pot in die brownie? Chocolade kan tests afwerpen
Hoeveel pot in die brownie? Chocolade kan tests afwerpen Op gallium gebaseerd oplosmiddel analyseert efficiënt optisch actieve alcoholen
Op gallium gebaseerd oplosmiddel analyseert efficiënt optisch actieve alcoholen
 Experimenteren essentieel om het aangetaste land van de aarde te redden
Experimenteren essentieel om het aangetaste land van de aarde te redden Biologische voeding biedt aanzienlijke milieuvoordelen voor plantrijke diëten
Biologische voeding biedt aanzienlijke milieuvoordelen voor plantrijke diëten Steden kunnen groeien zonder riffen en oceanen te slopen. Hier is hoe
Steden kunnen groeien zonder riffen en oceanen te slopen. Hier is hoe 11, 000 wetenschappers waarschuwen:klimaatverandering gaat niet alleen over temperatuur
11, 000 wetenschappers waarschuwen:klimaatverandering gaat niet alleen over temperatuur Goedkope drones vliegen de bossen ter wereld te hulp
Goedkope drones vliegen de bossen ter wereld te hulp
Hoofdlijnen
- Waar bevinden zich lipiden in het lichaam?
- Soorten forensische tests
- Hoe groeit schimmel op brood?
- Vijf nieuwe malariatargets die kunnen leiden tot een effectief vaccin
- Wie ontdekte hemoglobine?
- Onderzoek toont lagere letselpercentages bij Nieuw-Zeelandse renpaarden
- Dodelijke vispathogeen gedetecteerd in Australië
- Pompoengenomen gesequenced, ongewone evolutionaire geschiedenis onthullen
- Science Project on Why Bones krijgt Rubbery in Azijn
- Een exotische microbe en een ongebruikelijk extractieproces kunnen samen een economische manier zijn om een veelbelovende biobrandstof te maken

- Molecuul vliegsnelheid voor het opsporen van drugs

- Nieuwe technologie voor de levering van geneesmiddelen tegen kanker op aanvraag
- Levende elektroden met bacteriën en organische elektronica

- Van compost tot composiet:een milieuvriendelijke manier om rubber te verbeteren

 Een milieuopstand in de Mexicaanse inheemse steden
Een milieuopstand in de Mexicaanse inheemse steden Groot potentieel voor snellere diagnoses met nieuwe nano-methode
Groot potentieel voor snellere diagnoses met nieuwe nano-methode Aan 11 miljoen Brazilianen, de aarde is plat
Aan 11 miljoen Brazilianen, de aarde is plat Kunstmatige intelligentie gebruiken om zwaar weer beter te voorspellen
Kunstmatige intelligentie gebruiken om zwaar weer beter te voorspellen Stralingsdetecterend plastic krijgt ingrediënt om helder te blijven
Stralingsdetecterend plastic krijgt ingrediënt om helder te blijven Ruimtetelescoop die op asteroïden jaagt, krijgt missieverlenging van twee jaar
Ruimtetelescoop die op asteroïden jaagt, krijgt missieverlenging van twee jaar Moleculaire dansen bepalen hoe vloeistoffen warmte opnemen
Moleculaire dansen bepalen hoe vloeistoffen warmte opnemen Ogen in de ruimte om gevarenzones voor bosbranden te herkennen
Ogen in de ruimte om gevarenzones voor bosbranden te herkennen
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

