
Wetenschap
Door bacteriële enzymen te kopiëren, lab leert snel nieuwe klasse antibiotica moleculen schoon te synthetiseren, efficiënt
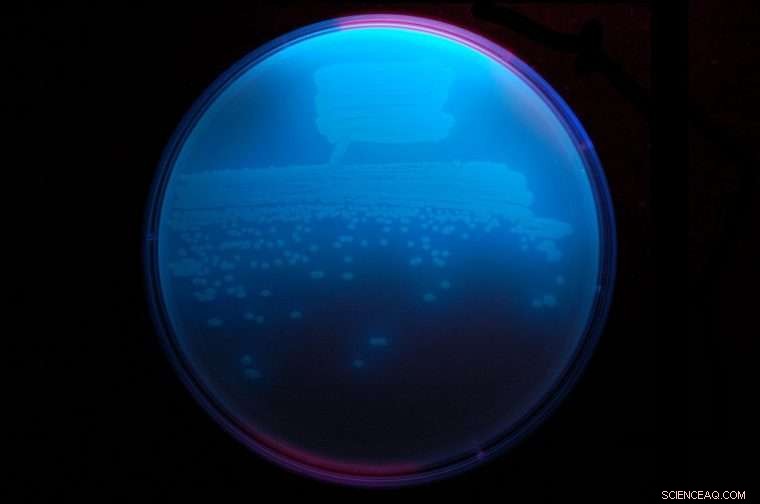
De bodembacterie Pseudomonas fluorescens, hier fel gloeien onder ultraviolet licht, straalt een antibioticum uit dat obafluorine wordt genoemd en dat een nieuwe ß-lactonstructuur heeft. Krediet:Washington University in St. Louis
Het actieve bestanddeel van het wondermiddel penicilline en verwante antibiotica zoals de cefalosporines is een "betoverde ring, " genaamd de β-lactam ring. Antibiotica die deze ringen bevatten, zijn misschien wel de belangrijkste medicijnen in de menselijke geschiedenis, eigenhandig de wereldwijde levensverwachting met naar schatting vijf jaar hebben verhoogd.
"Mensen zeggen vaak dat we geen antibiotica meer hebben, maar er zijn er meer dan 20, 000 moleculen met antibiotische activiteit in het Handbook of Antibiotics, " zei Timothy Wencewicz, een chemicus aan de Washington University in St. Louis die gespecialiseerd is in het ontwerpen van antibiotica.
"Minder dan 1 procent daarvan is ooit beschouwd als een potentiële klinische kandidaat. Ze kwijnen weg omdat het zoveel tijd en zorg kost om een molecuul klaar te maken voor gebruik als farmaceutisch middel.
Wencewicz koos zorgvuldig een van deze moleculen, obafluorine, voor verdere studie. Oblafluorine, ontdekt in 1984 door het Squibb Institute, wordt gemaakt door een fluorescerende stam van bodembacteriën die biofilms vormt op plantenwortels.
Zoals penicilline, obafluorin heeft een vierledige ring. Een vierledige ring belast de bindingshoeken die koolstof het liefst aanneemt, legt Wencewicz uit. "De stam verandert deze ringen in moleculaire bommen die afgaan wanneer ze op het juiste moment op de juiste plaats worden geplaatst, die nuttig is voor het doden van microben, " hij zei.
Maar omdat een ring met vier leden onstabiel is, deze moleculen zijn ook van korte duur en moeilijk te maken. Het duurde jaren voordat scheikundigen leerden hoe ze penicilline uit chemicaliën konden synthetiseren en vervolgens ontdekten hoe schimmels het maken. Het antibioticum wordt nog steeds gemaakt door een penicilline-afscheidende schimmelstam te fermenteren in gigantische roestvrijstalen vaten.
Het Wencewicz-lab was in staat om het hele proces over te slaan, genetica gebruiken om in te zoomen op de biosynthetische machinerie die bacteriën gebruiken om obafluorine te maken en vervolgens die meerstaps te reconstrueren, enzym-gekatalyseerd proces in het laboratorium.

De bètalactamring koppelt drie koolstoffen en een stikstof, terwijl de bèta-lactonring uit drie koolstoffen en een zuurstof bestaat. "Ze zijn in wezen iso-elektronen; ze zien er hetzelfde uit en ruiken hetzelfde, "Zei Wencewicz. "Maar zuurstof is iets anders dan stikstof, en dus hebben ze een ander palet van biologische activiteiten en remmen ze een andere set doelenzymen." Credit:Wencewicz
Wencewicz, afgestudeerde studenten Mars Reck en Jason Schaffer, en niet-gegradueerde Neha Prasad beschrijven de complete biosynthetische machinerie voor de assemblage van het ß-lactonobafluorin in het nummer van 15 mei van Natuur Chemische Biologie .
De ß-lactonen remmen een grote klasse enzymen die de serinehydrolasen worden genoemd. "Er zijn honderden bekende serinehydrolasen, en ze zijn betrokken bij veel menselijke ziekten, " zei Wencewicz. De ß-lactonen kunnen nuttig zijn bij de behandeling van kanker en obesitas, maar ook infectieziekten.
Een donker pad aan het licht gebracht
Obafluorine is een peptide, een korte keten van gekoppelde aminozuren. De meeste peptiden worden geproduceerd door een cellulaire machine genaamd het ribosoom, die een verscheidenheid aan peptiden maakt. Obafluorine, echter, wordt niet geassembleerd door het ribosoom maar door niet-ribosomale peptidesynthetase (NRPS), een meerdelig enzym dat slechts één type peptide synthetiseert.
De ribosomen maken de lange peptiden die eiwitten worden genoemd en die cruciaal zijn voor het leven, zei Wencewicz. Ribosomen zijn in de loop van miljoenen jaren geëvolueerd om ongelooflijk efficiënt en nauwkeurig te zijn, hij voegde toe, maar ze gebruiken een beperkte set aminozuurbouwstenen.
Antibiotica en andere secundaire metabolieten die nuttig maar niet essentieel zijn voor het leven, worden min of meer op aanvraag geassembleerd door NRPS-assemblagelijnen. Deze NRPS's zijn in staat om duizenden verschillende aminozuurbouwstenen te koppelen om structureel diverse kleine peptiden met belangrijke biologische activiteit te vormen.
NRPS's zijn in wezen een reeks enzymen die aan elkaar zijn geregen tot één groot eiwit met veel domeinen, die elk één stap in peptideassemblage uitvoeren. "Ze lijken een beetje op de assemblagelijnen van Henry Ford, ' zei Wencewicz.
Het laboratorium van Wencewicz identificeerde de genencluster in Pseudomonas die de NRPS fluorescerend maakt en maakte de vijf enzymen tot de genen die werden gecodeerd.
Vooral het vijfde enzym bleek interessant. Het is een ongebruikelijke thioesterase die verantwoordelijk is voor de vorming van een ß-lactonring wanneer het peptide vrijkomt uit het NRPS. In tegenstelling tot andere thioesterase-enzymen, de obafluorine-thioesterase omvat een zeldzaam katalytisch aminozuur dat een reactief thioester-tussenproduct genereert. Door deze ongebruikelijke chemie kan de NRPS de energiebarrière overwinnen die anders de vorming van een gespannen ring voorkomt.
Er volgen nog veel meer ringen
"We hebben nu een compleet enzymatisch platform om ß-lactonpeptiden te maken van eenvoudige uitgangsmaterialen, "Zei Wencewicz. "Omdat we de gensequenties kennen die coderen voor deze lopende band, we gebruiken de kracht van moderne genoomsequencing om nieuwe ß-lactonen van andere organismen te zoeken en te maken."
Iedereen die bekend is met de lange en frustrerende strijd om genoeg penicilline te produceren om gewonde soldaten tijdens de Tweede Wereldoorlog te helpen, kan zich alleen maar verbazen over de adembenemende vooruitgang in de genetica en chemie die het Wencewicz-lab in staat hebben gesteld het werk van vele decennia in een paar jaar te doen instorten.
 Science Projects on Dish Detergents
Science Projects on Dish Detergents Membraan geïnspireerd op bot en kraakbeen produceert efficiënt elektriciteit uit zout water
Membraan geïnspireerd op bot en kraakbeen produceert efficiënt elektriciteit uit zout water Nieuwe studie werpt licht op het ontwerpen van heterogene katalysatoren voor selectieve fotoreductie van koolstofdioxide
Nieuwe studie werpt licht op het ontwerpen van heterogene katalysatoren voor selectieve fotoreductie van koolstofdioxide Wat zijn de voordelen van HPLC over GC?
Wat zijn de voordelen van HPLC over GC?  Hydrogel 3D-print- en patroonvloeistoffen met het condensatorrandeffect (PLEEC)
Hydrogel 3D-print- en patroonvloeistoffen met het condensatorrandeffect (PLEEC)
Hoofdlijnen
- Nieuwe mutaties in iPS-cellen zijn voornamelijk geconcentreerd in niet-transcriptionele regio's
- Evolutionaire relaties tussen prokaryoten en eukaryoten
- Wat zijn de functies van mRNA & tRNA?
- Research Paper Onderwerpen in Biochemistry
- Genomische studie onderzoekt de evolutie van zachte killer-bijen in Puerto Rico
- Hoe symbiose werkt
- Voordelen van embryonale stamcelonderzoek
- Camponotini-mierensoorten hebben hun eigen verschillende microbiomen
- Chimpansees in het wild wijzigen waarschuwingen op basis van wat anderen in hun groep al weten, studie vondsten
- Kristalstructuurvoorspelling van willekeurige legering met meerdere elementen
- Nieuwe synthetische biologietools ontgrendelen complexe plantengineering
- Draagbare gasdetectie krimpt naar nieuwe dimensies

- Negatieve Celsius converteren naar Fahrenheit

- Duurzaam biomedisch hulpmiddel voor gebruik in regeneratieve geneeskunde

 3D-printen van kleine batterijen
3D-printen van kleine batterijen Vrouwen presenteren en rapporteren het nieuws nog steeds vaker dan erin verschijnen
Vrouwen presenteren en rapporteren het nieuws nog steeds vaker dan erin verschijnen Wat gebeurt er in de lichtreactie van fotosynthese?
Wat gebeurt er in de lichtreactie van fotosynthese?  PcFe-gekatalyseerde radicale fosfinoylazidatie van alkenen met een snelle azido-overdrachtsstap
PcFe-gekatalyseerde radicale fosfinoylazidatie van alkenen met een snelle azido-overdrachtsstap Bordeauxs waterspiegel is magisch,
Bordeauxs waterspiegel is magisch,  Ingenieurs bouwen drones om hypersonische technologie te testen
Ingenieurs bouwen drones om hypersonische technologie te testen Landen groeperen zich in clusters naarmate de COVID-19-uitbraak zich verspreidt
Landen groeperen zich in clusters naarmate de COVID-19-uitbraak zich verspreidt 10 Meest populaire vogels in Michigan
10 Meest populaire vogels in Michigan
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

