
Wetenschap
Chemici ontwikkelen nieuwe methode voor selectieve binding van eiwitten
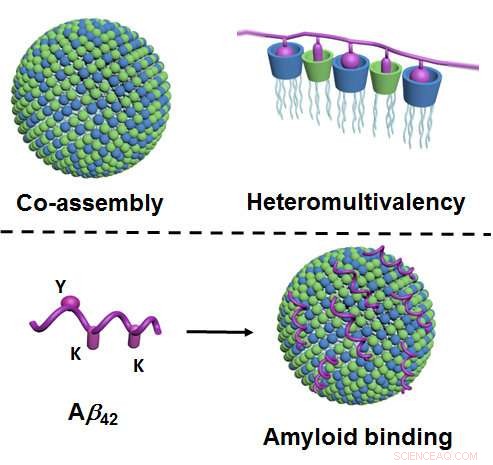
Figuurblad:Door co-montage, twee componenten van het lipide-type vormen nanodeeltjes in water die een zeer groot aantal verschillende contactpunten hebben (weergegeven in blauw en groen; links). Als gevolg van veel verschillende contactpunten die gelijktijdig met het eiwit interageren (weergegeven in violet), er treedt een bijzonder hoge mate van selectiviteit op ("heteromultivalentie", Rechtsaf). Figuur onder:Via hun contactpunten (groen en blauw), de nanodeeltjes binden de amyloïden - hier, specifiek, amyloïde-beta 42 (violet), en zo hun aggregatie te voorkomen. Binding vindt plaats via de corresponderende contactpunten op het amyloïde ("Y" en "K"; links). Credit:Universiteit van Münster - Bart Jan Ravoo
Een nieuwe methode om eiwitten selectief te binden aan nanodeeltjes is beschreven door een team van Duitse en Chinese onderzoekers onder leiding van prof. Bart Jan Ravoo, een chemicus aan de Universiteit van Münster (Duitsland). De nanodeeltjes herkennen automatisch specifieke peptiden, d.w.z. kleine eiwitten, en een zeer selectieve binding met hen aangaan. Onder de modelpeptiden die de onderzoekers onderzochten, bevonden zich amyloïden. Afzettingen van amyloïden spelen een belangrijke rol bij de ziekte van Alzheimer, bijvoorbeeld, dus hopen de onderzoekers dat het mechanisme dat ze hebben ontdekt een nieuwe benadering kan bieden voor de behandeling van ziekten waarbij dergelijke afzettingen voorkomen. De studie is gepubliceerd in het laatste nummer van Natuur Chemie.
De interactie tussen eiwitmoleculen of tussen hen en andere biomoleculen speelt bij heel veel fysiologische processen een grote rol. In deze context, moleculaire herkenning houdt de binding van eiwitten in via meerdere contactpunten op nanoschaal op het oppervlak van het eiwit. Typisch, heel veel van deze punten zijn betrokken, resulterend in een unieke, exact en complementair contactoppervlak. Het mechanisme waaraan deze eiwitmoleculen binden, wordt daarom beschreven als een 'sleutel-en-slotprincipe'. De onderzoekers hebben nu een methode beschreven om dergelijke contactoppervlakken op nanodeeltjes te produceren, zodat geselecteerde eiwitten kunnen worden gericht en gebonden.
Co-assemblage en "heteromultivalentie"
Nieuw aan de methode is dat deze gebaseerd is op de principes van co-assembly en zogenaamde heteromultivalentie. Co-assembly betekent dat de nanodeeltjes niet - zoals anders gebruikelijk - worden geproduceerd als resultaat van complexe en op maat gemaakte chemische synthese. In plaats daarvan, de onderzoekers produceren ze met een relatief eenvoudige methode waarbij twee lipide-type ("vette") componenten in water worden gemengd en spontaan de benodigde nanodeeltjes vormen. Deze deeltjes zijn adaptief, d.w.z. ze veranderen hun innerlijke structuur en bereiken zo een optimale binding aan het doeleiwit. "Heteromultivalentie" betekent dat de nanodeeltjes een zeer groot aantal verschillende contactpunten vormen die, tegelijkertijd, interactie met het eiwit. Naar het voorbeeld van natuurlijke fysiologische processen, Hierdoor treedt een bijzonder hoge selectiviteit op.
"Tot dusver, met name dit principe van heteromultivalentie is nauwelijks in detail onderzocht of benut, ", zegt Bart Jan Ravoo. "We beschrijven een geheel nieuwe aanpak die het mogelijk maakt om verdere synthetische eiwitbinders te ontwikkelen. Dit zou kunnen worden overwogen voor gebruik in diagnostiek of beeldvorming, of als potentiële actieve ingrediënten in medicijnen." De onderzoekers hebben aangetoond dat de nanodeeltjes binden met amyloïden en, als resultaat, aggregaten van deze peptiden op te lossen. Het optreden van amyloïde aggregaten is nauw verbonden met de ontwikkeling van de ziekte van Alzheimer. Dit is de reden waarom de nieuwe methode een aanpak kan bieden voor het ontwikkelen van nieuwe soorten behandelingen. Het is nog niet opgehelderd, echter, of de amyloïde aggregaten inderdaad de ziekte van Alzheimer veroorzaken of zijn, liever, een gevolg van de ziekte. Bovendien, de nieuwe methode voor het oplossen van de toeslagstoffen is alleen in een reageerbuis uitgeprobeerd. Verdere studies zijn daarom nodig om het potentieel ervan als behandelingsbenadering duidelijker te kunnen beoordelen.
De methode
De onderzoekers gebruikten amfifiele, in water oplosbare cyclodextrine- en calixareen-moleculen als co-assemblerende componenten voor de nano-contactpunten. Ze onderzochten de binding van de resulterende nanodeeltjes aan de peptiden, met behulp van bijvoorbeeld fluorescentiespectroscopie. Ze gebruikten elektronenmicroscopie om binding aan de amyloïden aan te tonen.
 Een oververzadigde oplossing maken met suiker
Een oververzadigde oplossing maken met suiker  Een halfgeleiderchip detecteert antigeenconcentraties bij 1 delen per quadriljoen molmassa
Een halfgeleiderchip detecteert antigeenconcentraties bij 1 delen per quadriljoen molmassa Medicijnen ontwerpen die gericht zijn op een ander deel van de levenscode
Medicijnen ontwerpen die gericht zijn op een ander deel van de levenscode Wetenschappers voorspellen een nieuw superhard materiaal met unieke eigenschappen
Wetenschappers voorspellen een nieuw superhard materiaal met unieke eigenschappen Onderzoekers onderzoeken waterstofbruggen met nieuwe techniek
Onderzoekers onderzoeken waterstofbruggen met nieuwe techniek
 Waarom je bijna zeker tijd verspilt aan het spoelen van je recycling?
Waarom je bijna zeker tijd verspilt aan het spoelen van je recycling? NASA berekende zware regenval die leidde tot modderstromen in Californië
NASA berekende zware regenval die leidde tot modderstromen in Californië Schone energie scoort een kleine overwinning
Schone energie scoort een kleine overwinning Zuid-Afrika om kolengestookte energie te verhogen, klimaatverontwaardiging aanwakkeren
Zuid-Afrika om kolengestookte energie te verhogen, klimaatverontwaardiging aanwakkeren Coronavirus:burgerwetenschap helpt bij het rapporteren van ecosysteemveranderingen tijdens de lockdown
Coronavirus:burgerwetenschap helpt bij het rapporteren van ecosysteemveranderingen tijdens de lockdown
Hoofdlijnen
- Centrosoom: definitie, structuur en functie (met diagram)
- Studie onderzoekt obesitas en reproductieve status van dierentuinolifanten
- Thuis op het strand:Antelope krijgt nieuwe opgravingen in New Orleans
- Masterchef-techniek blijkt levensreddend te zijn voor bedreigde zeeschildpadeieren
- Probeer deze 5 dagelijkse gewoonten om je leven dit jaar te verbeteren
- Een driedimensionaal model van een plantencel maken met labels
- Welke organen helpen het menselijk lichaam zich te ontdoen van verspillingen geproduceerd door cellen?
- Celcontacten in embryonale ontwikkeling bepalen cellulair lot
- Welke combinatie van chromosomen resulteert in een jongen?
- Medewerkers van de röntgenfaciliteit van Berkeley Labs mobiliseren zich om COVID-19-gerelateerd onderzoek te ondersteunen

- Nieuwe med-tech zinksensor ontwikkeld

- Op zoek naar verborgen toestanden van het COVID-19 spike-eiwit

- 'S Werelds eerste succes in asymmetrische borylering van ketonen
- Checkpointblokkade door een D-peptide voor kankerimmunotherapie
 Onderzoek identificeert refugia voor klimaatverandering in droge bosregio
Onderzoek identificeert refugia voor klimaatverandering in droge bosregio Wetenschappers analyseren 3D-model van eiwitten van ziekteverwekkende bacteriën
Wetenschappers analyseren 3D-model van eiwitten van ziekteverwekkende bacteriën De vijftig procent:de economische waarde van onderwijs
De vijftig procent:de economische waarde van onderwijs Bouwstenen van het leven kunnen zich lang voordat sterren vormen
Bouwstenen van het leven kunnen zich lang voordat sterren vormen Zuid-Afrikaanse wijnproductie droogt op door watercrisis
Zuid-Afrikaanse wijnproductie droogt op door watercrisis Regeling voor duurzame gecertificeerde palmolie haalt doelen niet
Regeling voor duurzame gecertificeerde palmolie haalt doelen niet Een moordzaak oplossen met natuurkunde
Een moordzaak oplossen met natuurkunde Hoe teken je een achthoek of 8-zijdige veelhoek
Hoe teken je een achthoek of 8-zijdige veelhoek
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

