
Wetenschap
Checkpointblokkade door een D-peptide voor kankerimmunotherapie
Krediet:Angewandte Chemie
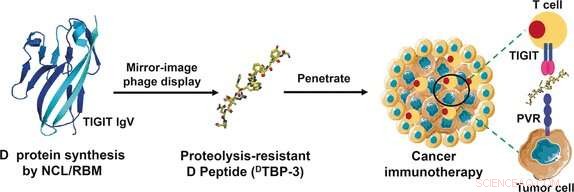
Ons immuunsysteem zou tumorcellen moeten kunnen herkennen en doden. Echter, veel tumoren misleiden het immuunsysteem. Bijvoorbeeld, ze induceren de zogenaamde immuuncontrolepunten van T-cellen om immuunreacties af te sluiten. In het journaal Angewandte Chemie , wetenschappers hebben nu een nieuwe benadering voor immunologische tumorbehandeling geïntroduceerd. Hun methode is gebaseerd op de specifieke blokkade van een immuuncheckpoint door een stabiel "spiegelbeeld"-peptide.
T-lymfocyten hebben verschillende immuuncontrolepunten op hun oppervlak, sommige die het immuunsysteem opkrikken en andere die immuunreacties onderdrukken wanneer ze geschikte liganden op de oppervlakken van "gecontroleerde" cellen "ontdekken". Een voorbeeld van zo'n immuuncheckpoint is het geprogrammeerde celdoodeiwit 1 (PD-1). Als het PD-L1-ligand is gebonden aan PD-1, de immuunrespons wordt geremd om een aanval op door het lichaam geproduceerde gezonde cellen te voorkomen. Helaas, veel tumoren "camoufleren" zichzelf met een bijzonder groot aantal PD-L1, die hen beschermt. Het blokkeren van de interactie tussen PD-1 en PD-L1 kan de kankerimmuniteit in de micro-omgeving rond tumoren normaliseren. Echter, eerdere therapeutische benaderingen hadden slechts beperkt succes, en de tumoren ontwikkelden vaak resistentie.
Een nieuw ontdekt immuuncontrolepunt, bekend als TIGIT, zou een alternatief aanvalspunt kunnen zijn. TIGIT reageert op een ligand genaamd PVR met een immunosuppressief signaal. Een team van onderzoekers van de Zhengzhou University in Zhengzhou, Tsinghua-universiteit in Peking, en Sun Yat-sen Universiteit in Shenzhen, onder leiding van Yanfeng Gao en Lei Liu gebruikten RNA-expressiegegevens van de Cancer Genome Atlas en Gene Expression Omnibus-dataset om te ontdekken dat TIGIT veel vaker voorkomt dan PD-1 in veel tumoren, inclusief degenen die resistent zijn tegen anti-PD-1-therapie.
De onderzoekers wilden een peptide gebruiken als hun nieuwe medicijn omdat deze moleculen dieper in weefsel doordringen met affiniteiten en specificiteiten die gelijk zijn aan die van antilichamen. Ze veroorzaken aanzienlijk minder ongewenste immunologische bijwerkingen en zijn gemakkelijker te produceren. Hun nadeel is dat ze snel worden afgebroken door proteasen in het lichaam. Om deze reden, de onderzoekers besloten om "spiegelbeeld"-peptiden te gebruiken, die stabiel zijn ten opzichte van proteasen. Aminozuren kunnen voorkomen in de natuurlijke L-configuratie, of zijn spiegelbeeld, de synthetische D-configuratie. D-peptiden gemaakt van D-aminozuren hebben een significant langere levensduur dan L-peptiden.
Om een geschikt peptide te vinden, de onderzoekers gebruikten de spiegelbeeld-faagweergavetechniek. Bij deze methode, zeer grote aantallen verschillende biotechnologisch geproduceerde peptiden worden gepresenteerd op het oppervlak van fagen (virussen die bacteriën aanvallen). Degenen die binden aan het gewenste doelmolecuul worden vervolgens geselecteerd en vermenigvuldigd in bacteriën. Vervolgens doorlopen ze verdere selectiecycli totdat er alleen zeer sterk bindende peptiden overblijven. aanvankelijk, L-peptiden worden gepresenteerd in faagweergave in spiegelbeeld. Echter, die geselecteerd binden aan het spiegelbeeld van het doelmolecuul. Voor deze, de onderzoekers synthetiseerden een deel van TIGIT in de D-configuratie. Als laatste stap, ze produceerden de spiegelbeeld D-versie van het sterkst bindende L-peptide, die perfect paste bij de sleutelbindingsinterface van het TIGIT/PVR-eiwit.
Het D-peptide dat door deze techniek is ontwikkeld, bekend als
NS
-TBP-3, blokkeert effectief de interactie van TIGIT met PVR, stabiel is ten opzichte van proteasen, en remt de groei en metastase van anti-PD-1-resistente tumormodellen.
 Mobiele telefoon-app levert nauwkeurige regenvalinformatie aan het publiek
Mobiele telefoon-app levert nauwkeurige regenvalinformatie aan het publiek Onderzoek suggereert dat vlees- en zuivelindustrie op schema ligt om oliemaatschappijen te overtreffen als grootste uitstoters van broeikasgassen
Onderzoek suggereert dat vlees- en zuivelindustrie op schema ligt om oliemaatschappijen te overtreffen als grootste uitstoters van broeikasgassen Met de grote op komst, aardbevingswaarschuwingssysteem wordt gelanceerd in Oregon
Met de grote op komst, aardbevingswaarschuwingssysteem wordt gelanceerd in Oregon Het effect van natuurrampen op liefdadigheids- en criminele activiteiten
Het effect van natuurrampen op liefdadigheids- en criminele activiteiten Een nieuwe methode produceert verbeterde kaarten voor oppervlaktebelasting
Een nieuwe methode produceert verbeterde kaarten voor oppervlaktebelasting
Hoofdlijnen
- Welke soort is het meest geschikt voor het leven? Allen hebben een gelijke kans, wetenschappers zeggen:
- Voordelen en nadelen van Hydrostatic Skeleton
- Het overdrachtspotentieel van vliegen kan groter zijn dan gedacht, onderzoekers zeggen:
- Hoe LEGO DNA-modellen te maken
- Japan doodt 177 walvissen in campagne in de Stille Oceaan:regering
- Soorten monomeren
- Chimerisme:je kunt je eigen tweeling zijn
- Wat is het Genotype voor de Roan-kleur?
- De isovormen van het HP1-eiwit reguleren de organisatie en structuur van heterochromatine
- Nieuw katalysatorcomposiet vermindert het gebruik van zeldzame aardelementen
- Video:Waar zijn eye crusties van gemaakt?

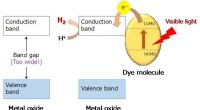
- Nieuw nanomateriaal ontwikkeld om watermoleculen te splitsen, verkrijgen van diwaterstof onder zonlicht
- Wie gaat er nu door met het valideren van forensische wetenschappelijke disciplines?

- Cafeïne vertraagt de beweging van watermoleculen

 Toegankelijke stages ondersteunen gelijkheid en diversiteit in techniek
Toegankelijke stages ondersteunen gelijkheid en diversiteit in techniek Ontwikkelingslanden moeten hun eigen koers uitstippelen naar netto nulemissie
Ontwikkelingslanden moeten hun eigen koers uitstippelen naar netto nulemissie Koolstof nanocomposieten zijn nu een stap dichter bij praktische industriële
Koolstof nanocomposieten zijn nu een stap dichter bij praktische industriële Waarom is de klantenservice zo slecht? Omdat het winstgevend is
Waarom is de klantenservice zo slecht? Omdat het winstgevend is Hoe Enterococcus Faecalis de Mannitol-zoutplaat verandert
Hoe Enterococcus Faecalis de Mannitol-zoutplaat verandert  Grafeen-DNA biosensor selectief, eenvoudig te maken
Grafeen-DNA biosensor selectief, eenvoudig te maken Curiosity rover-team onderzoekt nieuwe onderbreking van de boor
Curiosity rover-team onderzoekt nieuwe onderbreking van de boor Watersplitsing voor conversie van zonne-energie
Watersplitsing voor conversie van zonne-energie
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

