
Wetenschap
Een dag om de favoriete eenheid van scheikunde te vieren:de mol. Maar wat is een mol?

Mole Day is een onofficiële feestdag die op 23 oktober onder chemici wordt gevierd. tussen 06:02 en 18:02 De tijd en datum zijn afgeleid van het getal van Avogadro. Krediet:Ekaterina_Minaeva/Shutterstock.com
Op 23 oktober, tussen 06:02 en 18:02, scheikundigen vieren Molendag. Mole Day is geen dag om die harige kleine wezens te vieren die in de grond leven. Liever, het is een dag om een heel belangrijk idee in de submicroscopische wereld te vieren.
In de chemie, de mol is een eenheid die wordt gebruikt om over atomen te praten. Het is vergelijkbaar met andere eenheden die we elke dag gebruiken. Bijvoorbeeld, je kunt de plaatselijke donutwinkel binnenlopen en een dozijn donuts bestellen. Daarbij, u weet dat u 12 van deze snacks zult krijgen en de klerk weet u 12 te geven. De dozijneenheid is gewoon voor het gemak bij het bespreken van een hoeveelheid.
We passen hetzelfde idee toe om hoeveelheden atomen te bespreken. Waarom praten we niet gewoon over tientallen atomen? De reden is dat atomen zo klein zijn dat het geen zin heeft om dat te doen. Stel je een enkele korrel keukenzout voor. Dat kleine kristal bevat meer dan 1, 000, 000, 000, 000, 000, 000 (een triljoen) atomen. In plaats van zo'n groot aantal atomen te bespreken, we kunnen gemakkelijker praten via de moleenheid. Een mol van iets bevat 602, 000, 000, 000, 000, 000, 000, 000 of 6.02 x 10²³ van dat ding.
Dus in plaats van te praten over meer dan 1, 000, 000, 000, 000, 000, 000 atomen in de zoutkorrel, we kunnen de hoeveelheid uitdrukken als ongeveer 0,000002 mol atomen, wat veel handiger is.
Het getal 6.02 x 10²³ wordt ook wel het getal van Avogadro genoemd. Amedeo Avogadro was een Italiaanse natuurkundige. in 1811, hij stelde voor dat gelijke volumes van elk gas bij dezelfde temperatuur en druk hetzelfde aantal atomen (of moleculen) bevatten. Het nummer is naar hem vernoemd om zijn werk te eren. Omdat 23 oktober wordt afgekort als 23-10, scheikundigen gebruiken deze datum om Mole Day te vieren.
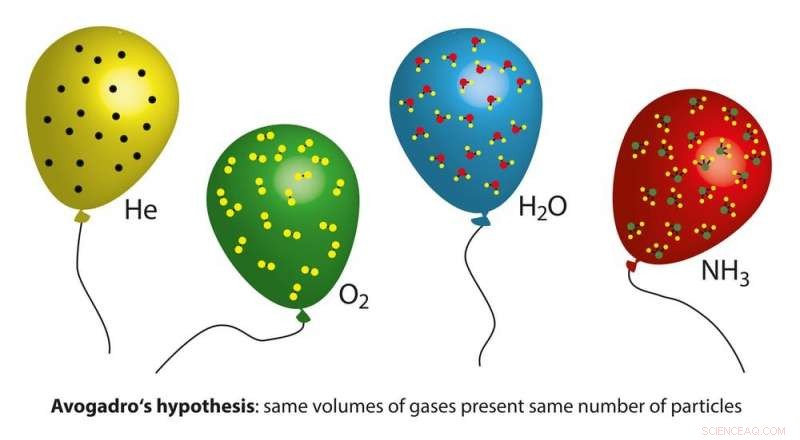
Amedeo Avogadro voorspelde dat gelijke volumes van verschillende gassen hetzelfde aantal moleculen zouden bevatten. Krediet:magnetix / Shuterstock.com
Hoeveel ruimte neemt een mol in?
Hoeveel is nu 6,02 x 10²³? Hoe lang denk je dat je nodig hebt om tot een mol te tellen? Op een dag? Een week? Een jaar? Doe Maar, beginnen met tellen. Het zou je ongeveer 20 kosten, 000, 000, 000, 000, 000 jaar. Zoals je kunt zien, zeer grote hoeveelheden atomen nemen heel weinig ruimte in beslag, wat ons een idee geeft van hoe klein ze zijn. Hier is nog een voorbeeld:één mol water met alle 6,02 x 10²³-moleculen H₂O neemt iets meer in beslag dan een eetlepel.
Dus hoe komen die kleine atomen samen om de dingen in de wereld om ons heen te vormen? Ook al zijn atomen zo klein, er is veel actie gaande. Elk atoom bestaat uit nog kleinere deeltjes die elektronen worden genoemd. De manier waarop die elektronen zich rond het atoom plaatsen, leidt tot eigenschappen die we kunnen ervaren en waarnemen. In een metalen, de kleine atomen zwemmen in een zee van elektronen waardoor ze warmte en elektriciteit kunnen geleiden.
Hoe zit het met water? De elektronen in een watermolecuul zijn zo gerangschikt dat elk watermolecuul extreem wordt aangetrokken door het watermolecuul ernaast. Hierdoor rangschikken ze zich van nature op atomair niveau op manieren die grote gevolgen hebben in de wereld om ons heen. Als water bevriest, de moleculen rangschikken op een manier die een rooster creëert dat ervoor zorgt dat ijs in vloeibaar water drijft. Waarom is dat zo belangrijk? Omdat ijs drijft, een vijver of meer zal aan de top bevriezen, maar beneden kan het hele aquatische ecosysteem overleven. Dit is een verbazingwekkend fenomeen van water.
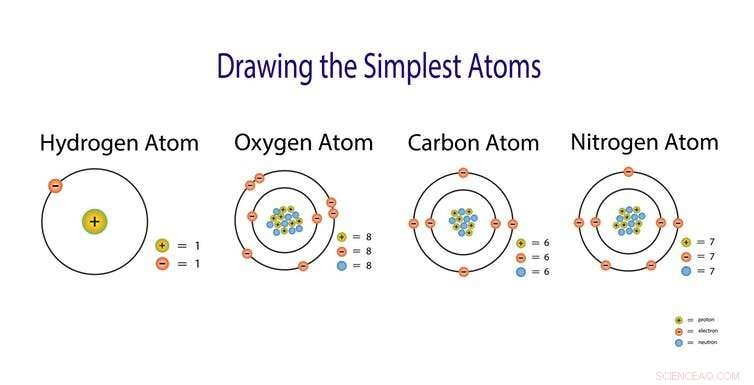
Atomen bestaan uit nog kleinere deeltjes die protonen worden genoemd, neutronen en elektronen. De rangschikking van deze deeltjes geeft elke stof specifieke eigenschappen. Krediet:Nasky / Shutterstock.com
Kleine atomen met grote gevolgen
Veel andere stoffen nemen hun eigen unieke eigenschappen aan vanwege de rangschikking van elektronen. Het propaangas dat we gebruiken om een gasbarbecue van brandstof te voorzien, is een gas op kamertemperatuur omdat de moleculen zwak tot elkaar worden aangetrokken. In tegenstelling tot water, ze willen eigenlijk helemaal niet naast elkaar zijn. Bijgevolg, de ruimte ertussen resulteert in een gasvormige toestand.
Een ander belangrijk gas is zuurstof. We hebben zuurstof nodig om ons leven te leiden. Sluit je ogen en haal diep adem. Terwijl je dat doet, de moleculen suizen door je neus, in uw longen, waar ongeveer 0,001 mol zuurstof in uw bloed wordt opgenomen. Die moleculen zijn verantwoordelijk voor het helpen van elke cel in je lichaam om energie te produceren, zodat je ogen de woorden op deze pagina kunnen zien en je hersenen kunnen nadenken over wat ze betekenen, allemaal terwijl je je hart blijft kloppen.
Dus, als je ooit het gevoel hebt dat je te onbeduidend bent om een verschil te maken, onthoud gewoon dat zelfs de kleinste dingen ertoe doen in het grote geheel van dingen.
Fijne Molendag!
Dit artikel is opnieuw gepubliceerd vanuit The Conversation onder een Creative Commons-licentie. Lees het originele artikel. 
 Herbebossing van Europa zou de regenval doen toenemen - nieuw onderzoek
Herbebossing van Europa zou de regenval doen toenemen - nieuw onderzoek Frankrijk bereidt zich voor op nieuw warmterecord terwijl Spanje wildvuur bestrijdt
Frankrijk bereidt zich voor op nieuw warmterecord terwijl Spanje wildvuur bestrijdt Onderzoekers presenteren een nieuwe synthetische kijk op de topografische evolutie van Tibet
Onderzoekers presenteren een nieuwe synthetische kijk op de topografische evolutie van Tibet Californië:plan van $ 400 miljoen om de grootste krimp van het meer te vertragen
Californië:plan van $ 400 miljoen om de grootste krimp van het meer te vertragen India zet zich schrap voor krachtige cycloon te midden van dodelijke virusgolf
India zet zich schrap voor krachtige cycloon te midden van dodelijke virusgolf
Hoofdlijnen
- Hoe een eenvoudige microscoop te maken
- Nieuw algoritme herkent duidelijke dolfijnklikken in onderwateropnamen
- Grootte is belangrijk - hoe trips hun partners kiezen
- Hoe orbitale diagrammen te doen
- Cryo-EM-beeldvorming suggereert hoe de dubbele helix scheidt tijdens replicatie
- Malawi wendt zich tot Britse troepen in stropersoorlog
- Studie maakt ingang naar landbouw zwanenhals zeepokken
- Ocean meeting haalt meer dan $7 miljard op voor mariene bescherming
- De meeste zeeschildpadden zijn nu vrouwelijk in het noorden van het Great Barrier Reef
- Glyfosaat kan de menselijke darmflora beïnvloeden
- Nieuw ontwikkelde molecule om geneesmiddelen te verbeteren, haalt inspiratie uit de gereedschapskist van de natuur

- Open-sourcesoftware verwerkt snel spectrale gegevens, identificeert en kwantificeert nauwkeurig lipidensoorten

- Onderzoekers ontwikkelen goedkope, drop-on-demand printtechniek

- Geavanceerde computers effent de weg naar de toekomst van NMR-spectroscopie

 Wat is de rol van enzymen in het metabolisme?
Wat is de rol van enzymen in het metabolisme?  Agrarisch duurzaamheidsproject bereikte 20,9 miljoen kleine boeren in heel China
Agrarisch duurzaamheidsproject bereikte 20,9 miljoen kleine boeren in heel China Welke organel moet aanwezig zijn in grote aantallen in spiercellen?
Welke organel moet aanwezig zijn in grote aantallen in spiercellen?  Computermodellen vinden oude oplossingen voor moderne problemen
Computermodellen vinden oude oplossingen voor moderne problemen Onder het noorderlicht:uitputting van de mesosferische ozonlaag uitgelegd
Onder het noorderlicht:uitputting van de mesosferische ozonlaag uitgelegd Mooie zonnige dagen kunnen uitgroeien tot hittegolven en bosbranden - het zomerweer houdt op
Mooie zonnige dagen kunnen uitgroeien tot hittegolven en bosbranden - het zomerweer houdt op Rube Goldberg Projectideeën
Rube Goldberg Projectideeën Hoe Euclidische afstand berekenen
Hoe Euclidische afstand berekenen
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Portuguese | Swedish | German | Dutch | Danish | Norway | Spanish |

-
Wetenschap © https://nl.scienceaq.com

