Wetenschap
Cryo-EM-beeldvorming suggereert hoe de dubbele helix scheidt tijdens replicatie
DNA volgt een zigzagpad in een kanaal gecreëerd door twee 6-zijdige ringen. Dit nieuwe atomaire niveau, gemaakt met cryo-EM-technologie, suggereert hoe DNA interageert met de twee ringen net voordat het wordt gescheiden in 'leidende' en 'achterblijvende' strengen. Al het leven hangt af van absoluut nauwkeurige choreografie, wanneer een cel zijn DNA moet repliceren om twee cellen te maken. Krediet:Van Andel Research Institute
Het leven zou onmogelijk zijn als het DNA in delende cellen zou worden gerepliceerd met iets minder dan bijna perfecte precisie. Elke keer dat een cel met kern zich ertoe verbindt twee cellen te worden, elke "letter" van zijn genoom moet één keer en slechts één keer worden gerepliceerd. In mensen, de taak verbijstert de verbeelding. Indien afgewikkeld, de dubbele helix die in elk van onze cellen is gepropt, zou 1,80 meter lang zijn. Alleen in ons beenmerg, elke minuut worden er een half miljard nieuwe cellen geboren. Deze cellen alleen al bevatten genoeg DNA om 25 keer rond de evenaar te wikkelen. Binnen ontmoedigende toleranties, elke nieuwe cel moet een genoom hebben dat identiek is aan dat van de cel waaruit het is voortgekomen. Kanker en andere ziekten kunnen het gevolg zijn wanneer het proces misgaat.
Uitzoeken hoe nauwkeurige replicatie werkt op het niveau van individuele moleculen en atomen is een van de grote prestaties van de moderne wetenschap. De reis van de onderzoekers is nog niet gedaan, echter. Een belangrijk onopgelost deel van de puzzel is begrijpen hoe het hele proces van het kopiëren van het genoom begint. Bij nieuw onderzoek inzicht in hoe de twee stands van de dubbele helix scheiden in de vroegste stadia van replicatie wordt duidelijk.
Een langdurige samenwerking van onderzoekers in Londen, Grand Rapids, Michigan en Cold Spring Harbor Laboratory (CSHL) in New York rapporteren de structuur op atomair niveau van dubbele helicase-enzymen die kop aan kop worden geladen, met de dubbele DNA-helix zichtbaar in het cirkelvormige kanaal dat door beide helicases loopt. De configuratie, een deel van het pre-replicatieve complex (pre-RC), is nog nooit met succes afgebeeld in deze configuratie.
De prestatie werd mogelijk gemaakt door een nieuwe cyro-elektronenmicroscopie (cryo-EM) faciliteit bij het Van Andel Research Institute, huis van een van de hoofdonderzoekers, Dr Huilin Li. Dr. Li heeft samengewerkt met Dr. Bruce Stillman van CSHL en Dr. Christian Speck, Al meer dan twaalf jaar hoogleraar genoombiochemie en moleculaire biologie aan het Imperial College in Londen. 1992, Stillman en collega's ontdekten het eiwitcomplex dat het oorsprongsreplicatiecomplex (ORC) wordt genoemd, die eiwitcomplexen assembleert op vele locaties genaamd "startplaatsen" langs de dubbele helix, waar de replicatie begint. Het werk van Dr. Speck toonde aan dat ORC combineert met andere eiwitten - Cdc6, Cdt1 en het hexameer van Mcm2-7 - om het proces van het dupliceren van DNA te beginnen.
Veel inspanningen in het verleden hebben onthuld hoe ORC startsites verzamelt en vindt. Er zijn veel van dergelijke sites, georganiseerd door domeinen, in het complexe menselijke genoom; veel minder in eenvoudigere levensvormen zoals bakkersgist. Het nieuwe onderzoek gaat over wat er gebeurt na de eerste herkenning van de startplaatsen en hoe de DNA-helix kan worden afgewikkeld.
De dubbele DNA-helix volgt een zigzagpad in een kanaal gecreëerd door twee 6-zijdige ringen. Deze nieuwe weergave op atomair niveau, gemaakt met cryo-EM-technologie, suggereert hoe DNA interageert met de twee ringen net voordat het wordt gescheiden in 'leidende' en 'achterblijvende' strengen. Al het leven hangt af van absoluut nauwkeurige choreografie, wanneer één cel zijn DNA moet repliceren om twee cellen te maken. Krediet:Van Andel Research Institute
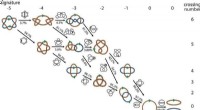
Zoals levendig getoond in de nieuwe cryo-EM "foto's, " de twee zeszijdige Mcm2-7 helicase-enzymen die de dubbele helix omringen, zien eruit als symmetrische insecten of, misschien, tweeling ruimtevaartuig tegen elkaar aangemeerd. De vraag die door de nieuwe structuur wordt beantwoord, is hoe de dubbele helix zich bevindt binnen het kanaal dat ze vormen, en hoe DNA interageert met de omringende structuur. Op basis van die nieuwe kennis, inzicht in hoe de twee DNA-strengen uit elkaar gaan, lang een mysterie, begint bloot te leggen.
"De nieuwe afbeeldingen laten zien dat eenmaal geladen in de dubbele hexameer - of DH, zoals we de head-to-head helicases noemen - de dubbele helix neemt een zigzaggend pad door het centrale kanaal, die is een beetje geknikt, " leggen de auteurs uit. "De twee tonvormige hexameren zijn zo opgesteld dat ze klaar zijn om de dubbele helix los te draaien wanneer ze worden geactiveerd."
Eén consequentie is vooral belangrijk:de draaiing in de structuur van het complex gevormd door de dubbele ringen zorgt voor een torsiebelasting:ze belasten met een inherente spanning waardoor ze zoiets als een spiraalveer worden. Details in de structuur die nog niet eerder zijn gezien, onthullen hoe verschillende eiwitsubeenheden van de tweelinghexameren zich vastklampen aan de dubbele helix, via kleine lusachtige structuren.
Het scenario van Li, Vlek, Stillman en hun collega's is dat de tweelinghexameren onder spanning worden geladen, waardoor een van de twee strengen van het DNA die erdoorheen gaan letterlijk tegen een gesloten "deur" aan één kant van de ring komt, en de andere streng tegen een andere gesloten "deur" aan de andere kant. Het team stelt voor dat een van de twee deuren openspringt wanneer het replicatieproces wordt geactiveerd (door tussenkomst van proteïnekinasen en andere helpermoleculen).
Door de open deur in de helicase - maar slechts aan één kant - wordt een streng van de dubbele helix naar buiten geduwd, of "geëxtrudeerd". Het team stelt voor dat het de "achterblijvende streng" wordt in het DNA-replicatieproces. De andere streng, in het midden van het spiraalvormige kanaal blijven, wordt de "leading streng" in replicatie. Moleculaire motoren die op de twee hexameren zijn geladen, leveren energie voor hun scheiding. De ene geactiveerde helicase passeert de andere, als replicatie van elke streng in tegengestelde richtingen verloopt, zoals decennia geleden door biologen is afgeleid.
De nieuwste structuren zijn mogelijk gemaakt door vooruitgang in de techniek die cryo-elektronenmicroscopie wordt genoemd, waar een elektronenbundel bevroren wordt doorgelaten, enkele eiwit-DNA-deeltjes om een bijna atomair 3-dimensionaal beeld te verkrijgen. De belangrijkste ontwikkelaars van de methode, die nu veel wordt gebruikt, ontving in 2017 de Nobelprijs voor Scheikunde.
 GPM-satelliet verkrijgt uitstekende beelden van Beryls-restanten
GPM-satelliet verkrijgt uitstekende beelden van Beryls-restanten NASA's langstlopende onderzoek naar door ijs verbrijzelde records in 2017
NASA's langstlopende onderzoek naar door ijs verbrijzelde records in 2017 Flood-projecten voor School
Flood-projecten voor School Waarom hebben waterplanten huidmondjes op het bovenste deel van hun bladeren?
Waarom hebben waterplanten huidmondjes op het bovenste deel van hun bladeren?  Sigaretten zijn goed voor de helft van het afval dat wordt teruggewonnen op de kusten van Vancouver en Victoria
Sigaretten zijn goed voor de helft van het afval dat wordt teruggewonnen op de kusten van Vancouver en Victoria
Hoofdlijnen
- Biologen onderzoeken de moleculaire onderbouwing van cellen die herstellen van de rand van geprogrammeerde dood
- Grote bedreigingen voor bodemecosystemen door een combinatie van invasieve soorten en klimaatverandering
- Hier ziet u hoe het einde van de zomertijd u kan beïnvloeden
- Zeeschildpadden sterven nadat ze verstrikt zijn geraakt in plastic afval
- Een dierencel maken voor een wetenschapsproject
- Wetenschapsprojecten over Dominant en Recessieve Genen
- Zenuwonderzoek laat zien hoe cellen zich aanpassen om schade te helpen herstellen
- Wat is een positieve controle in de microbiologie?
- Oncogene: wat is het? & Hoe beïnvloedt het de celcyclus?
 Mobiele gezondheidsapplicaties brengen de persoonlijke gegevens van miljoenen gebruikers in gevaar
Mobiele gezondheidsapplicaties brengen de persoonlijke gegevens van miljoenen gebruikers in gevaar Onderzoek ingesteld om de chaotische mysteries van turbulentie te onthullen
Onderzoek ingesteld om de chaotische mysteries van turbulentie te onthullen Kwantumwaarnemers hebben mogelijk recht op hun eigen feiten
Kwantumwaarnemers hebben mogelijk recht op hun eigen feiten Team detecteert pathogene bacteriën in grondwater in Texas nabij aardgaswinningslocaties
Team detecteert pathogene bacteriën in grondwater in Texas nabij aardgaswinningslocaties Hoe Lunar Liquid Mirror Telescopen werken
Hoe Lunar Liquid Mirror Telescopen werken  Wat is een deltaland vorm?
Wat is een deltaland vorm?  De ontdekking van de oude Griekse popcultuur herschrijft de geschiedenis van poëzie en zang
De ontdekking van de oude Griekse popcultuur herschrijft de geschiedenis van poëzie en zang In vuil levende microbe produceert potentieel wapen tegen melanoom
In vuil levende microbe produceert potentieel wapen tegen melanoom
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com