Wetenschap
De geheime sulfaatcode die de slechte Tau binnenlaat
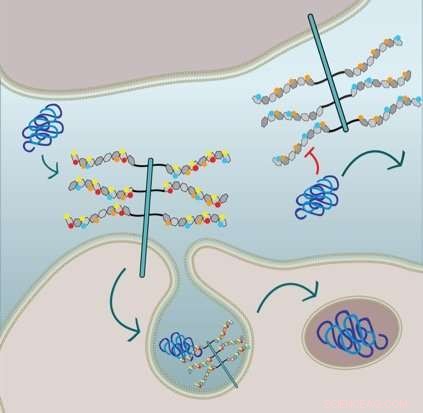
De figuur laat zien dat cellulaire tau-fibrilopname 6-O-sulfatie en N-sulfatie van de HSPG-zijketens vereist:de cel in de onderste helft brengt HSPG's tot expressie met alle sulfaatresten en internaliseert tau via macropinocytose. De cel in de bovenste helft is genetisch gemodificeerd en mist N-sulfatie (rode cirkels) en 6-O-sulfatie (gele cirkels) en dus, tau fibril opname wordt geremd. Krediet:Sandi Jo Estill-Terpack, Barbara Stopschinsky
Vampieren kunnen mensen in vampiers veranderen, maar om het huis van een mens binnen te gaan, ze moeten binnen worden uitgenodigd. Onderzoekers van het UT Southwestern Medical Center, schrijven in de Tijdschrift voor biologische chemie , hebben details blootgelegd over hoe cellen gecorrumpeerde eiwitten uitnodigen die normale eiwitten corrupt kunnen maken, leiden tot neurodegeneratieve ziekten zoals de ziekte van Alzheimer en Parkinson. Inzicht in de moleculaire details van hoe deze eiwitten zich van cel tot cel verspreiden, zou kunnen leiden tot therapieën om de ziekteprogressie te stoppen.
Alzheimer en Parkinson worden in verband gebracht met bepaalde eiwitten in de hersenen die zich verkeerd vouwen, aggregeren, en het induceren van normale eiwitten om verkeerd te vouwen en te aggregeren. De groep van Marc Diamond aan de UT Southwestern ontdekte in 2013 dat om nieuwe cellen binnen te gaan en verkeerd vouwen te verspreiden, de ziekte-geassocieerde eiwitten tau, alfa-synucleïne en amyloïde-bèta moeten binden aan een type suiker-eiwitmolecuul dat heparansulfaat-proteoglycaan (HSPG) wordt genoemd op het celoppervlak. Deze binding triggert de cel om het beschadigde eiwit naar binnen te brengen. In de nieuwe studie de groep probeerde meer te begrijpen over hoe dit proces werkte.
"De vraag was hoe specifiek is dit (proces)? Of is het helemaal niet specifiek?" vroeg Barbara Stopschinski, de arts en onderzoeker in Diamond's lab die toezicht hield op het nieuwe werk. Wat waren de details van de chemische communicatie tussen HSPG en tau die ervoor zorgde dat tau de cellen binnenkwam? En was dit proces anders voor alfa-synucleïne (geassocieerd met de ziekte van Parkinson), amyloïde-beta en tau (beide geassocieerd met de ziekte van Alzheimer)?
HSPG's kunnen verschillende afmetingen en structuren hebben; ze kunnen worden versierd met verschillende patronen van suikers, en de suikers kunnen zelf verschillende patronen van zwavelbevattende groepen (sulfaatresten) bevatten. Stopschinski testte systematisch hoe verschillende patronen van sulfaatgroepen de binding en opname in cellen van alfa-synucleïne beïnvloedden, amyloïde-beta en tau.
Ze ontdekte dat verkeerd gevouwen tau cellen alleen kon binnendringen via een zeer specifiek gedecoreerde en gemodificeerde HSPG. Amyloïde-beta en alfa-synucleïne, anderzijds, waren flexibeler in de soorten sulfaatgroepen die hun opname veroorzaakten. Verder, Stopschinski identificeerde de enzymen in de cellen die bepaalde sulfateringspatronen in HSPG's creëerden. Toen deze enzymen werden verwijderd, verkeerd gevouwen tau werd niet langer opgenomen in cellen, vermoedelijk omdat HSPG-suikerdecoraties en sulfateringspatronen veranderden, wat betekent verkeerd gevouwen tau kende het moleculaire wachtwoord niet meer.
Het team wil nu begrijpen of deze processen in de hersenen op dezelfde manier werken als in culturen van hersencellen. Diamond hoopt dat het begrijpen hoe beschadigde eiwitten tussen hersencellen bewegen, zal leiden tot manieren om ze te stoppen.
"Er is iets heel opmerkelijks aan hoe efficiënt een cel deze aggregaten zal opnemen, breng ze naar binnen en gebruik ze om meer te maken, " zei Diamond. "Deze kennis heeft belangrijke implicaties voor ons begrip van hoe neurodegeneratieve ziekten in de loop van de tijd erger worden. Omdat we specifieke enzymen hebben geïdentificeerd die kunnen worden geremd om dit proces te blokkeren, dit zou kunnen leiden tot nieuwe therapieën."
 Nieuwe methode richt zich op ziekteverwekkende eiwitten voor vernietiging
Nieuwe methode richt zich op ziekteverwekkende eiwitten voor vernietiging Apparaat kan tekenen van buitenaards leven helpen detecteren
Apparaat kan tekenen van buitenaards leven helpen detecteren Bij welke temperatuur en druk kunnen alle drie fasen van water gelijktijdig bestaan?
Bij welke temperatuur en druk kunnen alle drie fasen van water gelijktijdig bestaan?  Schone waterstof maken is moeilijk, maar onderzoekers hebben zojuist een grote hindernis opgelost
Schone waterstof maken is moeilijk, maar onderzoekers hebben zojuist een grote hindernis opgelost Wat zijn de effecten van antivries op het milieu?
Wat zijn de effecten van antivries op het milieu?
Hoofdlijnen
- Wat zijn de effecten van isolatie in de geest?
- Regenwormen kunnen zich voortplanten in Mars-bodemsimulant
- Hoe maak je een 3D-celmembraamodel
- Verbergen of opgegeten worden, urinechemicaliën vertellen modderkrabben
- Namen van de enzymen in de mond & slokdarm
- Genetische modificatie: definitie, soorten, proces, voorbeelden
- Kiemvrije broedeieren:een alternatief voor het gebruik van formaldehyde
- Maleisië omarmt het werk van Melanies aan de illegale handel in wilde dieren
- Wetenschappers stellen universele wetten voor over de grootte en biologie van plantenzaden
 Schroefkanker:Microneedle plakt het aan kankerweefsel
Schroefkanker:Microneedle plakt het aan kankerweefsel Een 3D-reconstructie van het fossiel maakte de beschrijving van een geheel nieuwe onderorde mogelijk
Een 3D-reconstructie van het fossiel maakte de beschrijving van een geheel nieuwe onderorde mogelijk Onderzoek haalt de kou weg van ijzige opbouw op vliegtuigen en windturbines
Onderzoek haalt de kou weg van ijzige opbouw op vliegtuigen en windturbines North Pacific Subtropical High-modellen voorspellen zomermoessons, minder aanlandingen door tyfoons
North Pacific Subtropical High-modellen voorspellen zomermoessons, minder aanlandingen door tyfoons Cynisme, autonomie en werkplezier:bewijs uit het lerarenberoep
Cynisme, autonomie en werkplezier:bewijs uit het lerarenberoep Mysterieuze ster 21 Comae opnieuw onderzocht met MOST-satelliet
Mysterieuze ster 21 Comae opnieuw onderzocht met MOST-satelliet Vortexfotonen van elektronen in cirkelvormige beweging
Vortexfotonen van elektronen in cirkelvormige beweging Hoe recycleert de inktcartridges de aarde niet?
Hoe recycleert de inktcartridges de aarde niet?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com