
Wetenschap
Simulatie van het AsqJ-enzym opent nieuwe mogelijkheden voor farmaceutische chemie
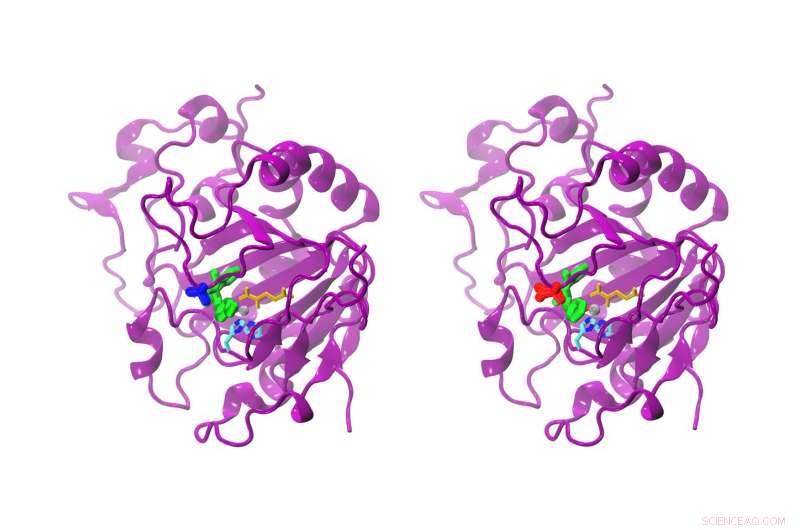
Hoewel het verschil tussen het natuurlijke en het gemodificeerde AsqJ slechts één aminozuur is, de reactiviteit is duidelijk anders. De natuurlijke AsqJ (links) heeft een valine op positie 72 (blauw). De gemodificeerde vorm bezit een isoleucine (rood) op positie 72. Het substraat in de actieve plaats is groen gekleurd, alfa-ketoglutaraat geel, het ijzeratoom grijs, en twee histidineketens cyaan en blauw. Krediet:Sophie Mader/TUM
Bij vrijwel alle biochemische processen zijn enzymen betrokken die chemische reacties versnellen. Een onderzoeksteam van de Technische Universiteit van München (TUM) heeft nu voor het eerst het moleculaire mechanisme van het enzym AsqJ ontcijferd. Hun bevindingen kunnen nieuwe mogelijkheden bieden voor de productie van farmaceutisch actieve moleculen.
Zonder enzymen, de natuur zou tot stilstand komen. Deze minuscule moleculen versnellen biochemische reacties of maken ze in de eerste plaats mogelijk. Maar hoe gebeurt dit op moleculair niveau? "Het begrijpen van de exacte functie van enzymen is een van de grootste uitdagingen van de moderne biochemie, " zegt Ville Kaila, Hoogleraar Computational Biokatalyse aan de Technische Universiteit van München.
Het onderzoeksteam onder leiding van Ville Kaila en Michael Groll, Hoogleraar biochemie aan de Technische Universiteit van München, hebben, Voor de eerste keer, ontcijferde het mechanisme van het enzym aspoquinolone J (AsqJ), een dioxygenase dat koolstofbindingen met zuurstof activeert.
Het enzym AsqJ is bijzonder opwindend omdat het een cascade van chemische reacties katalyseert die uiteindelijk leiden tot de vorming van antibacteriële verbindingen. Het werd pas een paar jaar geleden ontdekt in de Aspergillus nidulans schimmel. De onderzoekers combineerden verschillende methoden om de geheimen van het enzym te ontdekken:Alois Bräuer en prof. Michael Groll gebruikten röntgenkristallografie om de driedimensionale atomaire structuur van het molecuul te bepalen. Sophie Mader en Ville Kaila gebruikten deze informatie vervolgens om kwantummechanische simulaties uit te voeren op hun biochemische processen.
"Onze berekeningen illustreren hoe het enzym de vorming van chinolon-alkaloïde katalyseert, " meldt Kaila. "Kleine details hebben verbazingwekkende effecten:een kleine verandering in het substraat, zoals het verwijderen van een kleine chemische groep, is voldoende om de reactie praktisch te stoppen."
Volgende, het team ontwierp computationeel een nieuwe variant van het enzym dat de vorming van chinolon-alkaloïden katalyseert met het gemodificeerde substraat. Dit nieuwe enzym werd experimenteel geproduceerd in bacteriën en getest op zijn functionaliteit. "De resultaten waren indrukwekkend:de verwachte reactie vond plaats na slechts enkele seconden, " herinnert Bräuer zich.
"Dit experiment toont aan dat onze methodologie werkt en ook geschikt is om de functionaliteit van andere enzymen op moleculair niveau weer te geven, ", zegt Ville Kaila. Enzymontwerp is nog steeds op een basisniveau, maar het heeft een enorm potentieel. In de toekomst, we zouden kunnen streven naar het computationeel ontwerpen van medicijnen, bijvoorbeeld.
"Het werk toont aan dat onze methodologie nauwkeurig is en ook zeer geschikt om de functionaliteit van andere enzymen op moleculair niveau te bestuderen, ", zegt Ville Kaila. Enzymontwerp is nog steeds fundamenteel onderzoek - maar het heeft een enorm potentieel. Een doel van toekomstig onderzoek zal zijn om enzymen in een computer te ontwerpen om, bijvoorbeeld, nieuwe medicijnen produceren.
 Hoe kolibries te voeden Graansiroop
Hoe kolibries te voeden Graansiroop  Koolstofbrandstoffen worden groen voor hernieuwbare energie
Koolstofbrandstoffen worden groen voor hernieuwbare energie Plantaardige verbinding zou een sleutelrol kunnen spelen bij het bestrijden van de ziekte van Alzheimer
Plantaardige verbinding zou een sleutelrol kunnen spelen bij het bestrijden van de ziekte van Alzheimer Het effect van ureumadditieven op de fysisch-chemische eigenschappen van kristallen
Het effect van ureumadditieven op de fysisch-chemische eigenschappen van kristallen Lakmoespapier Types
Lakmoespapier Types
 Snellere CO2-uitstoot kan 153 miljoen levens redden
Snellere CO2-uitstoot kan 153 miljoen levens redden Tropical Rain Forest Biome Landscape Kenmerken
Tropical Rain Forest Biome Landscape Kenmerken  Waarom het verhogen van de productie van schaliegas de uitstoot van broeikasgassen niet zal verminderen?
Waarom het verhogen van de productie van schaliegas de uitstoot van broeikasgassen niet zal verminderen? In het zuiden van Irak, droogte verstevigt zijn greep
In het zuiden van Irak, droogte verstevigt zijn greep De klodder abnormale omstandigheden verhoogde de ozonniveaus in de westerse VS
De klodder abnormale omstandigheden verhoogde de ozonniveaus in de westerse VS
Hoofdlijnen
- Alfred Russel Wallace: Biography, Theory of Evolution & Facts
- Het verschil tussen de genoom-DNA-extractie tussen dieren en planten
- Brandende chili houdt olifanten op afstand, nieuwe studie vondsten
- Woordproblemen schrijven voor Math
- Wat is een IQ van een persoon?
- Voors en tegens van Recombinant DNA Technology
- Hoe isoleer ik bacteriën uit de bodem?
- De structuur en functie van een cel
- Vijf stappen om Agar te bereiden Slants
- Grieppandemieën in de kiem smoren

- Nanokristallen helpen bij het detecteren van methanol en andere alcoholen

- Onderzoekers gebruiken neurale netwerken voor geurherkenning

- Nieuw wereldrecord in materiaalonderzoek:röntgenmicroscopie met een snelheid van 1000 tomogrammen per seconde
- Biologen ontdekken carotenoïdenoverdracht tussen twee eiwitten

 Het geheim van het verbeteren van de mechanische prestaties van vloeibare kristallen
Het geheim van het verbeteren van de mechanische prestaties van vloeibare kristallen Manieren om te voorkomen dat studenten mobiele telefoons gebruiken in Class
Manieren om te voorkomen dat studenten mobiele telefoons gebruiken in Class Duitse kruisboog YouTuber vecht videogigant voor rechten
Duitse kruisboog YouTuber vecht videogigant voor rechten Nieuwe methode voor betere interactie tussen laser en materiaal
Nieuwe methode voor betere interactie tussen laser en materiaal Gelijkaardige richels op Mars hebben verschillende oorsprongen
Gelijkaardige richels op Mars hebben verschillende oorsprongen Wegversperringen naar succes voor promovendi kunnen gemiste kansen betekenen voor Canada
Wegversperringen naar succes voor promovendi kunnen gemiste kansen betekenen voor Canada Hoe bewegen aardwormen?
Hoe bewegen aardwormen?  Vero:Hot Instagram-alternatief - maar blijft het bestaan?
Vero:Hot Instagram-alternatief - maar blijft het bestaan?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

