
Wetenschap
Plantaardige verbinding zou een sleutelrol kunnen spelen bij het bestrijden van de ziekte van Alzheimer

betanine, een stof die voorkomt in bieten, zou uiteindelijk de progressie van de ziekte van Alzheimer kunnen vertragen. Krediet:Darrell Cole Cerrato
Een verbinding in bieten die de groente zijn kenmerkende rode kleur geeft, kan uiteindelijk de ophoping van verkeerd gevouwen eiwitten in de hersenen helpen vertragen. een proces dat wordt geassocieerd met de ziekte van Alzheimer. Wetenschappers zeggen dat deze ontdekking zou kunnen leiden tot de ontwikkeling van medicijnen die enkele van de langetermijneffecten van de ziekte kunnen verlichten, 's werelds belangrijkste oorzaak van dementie.
De onderzoekers presenteren hun werk vandaag op de 255e National Meeting &Exposition van de American Chemical Society (ACS).
"Onze gegevens suggereren dat betanine, een verbinding in bietenextract, enige belofte vertoont als een remmer van bepaalde chemische reacties in de hersenen die betrokken zijn bij de progressie van de ziekte van Alzheimer, " zegt Li-June Ming, doctoraat "Dit is nog maar een eerste stap, maar we hopen dat onze bevindingen andere wetenschappers zullen aanmoedigen om op zoek te gaan naar structuren die vergelijkbaar zijn met betanine die kunnen worden gebruikt om medicijnen te synthetiseren die het leven een beetje gemakkelijker kunnen maken voor degenen die aan deze ziekte lijden."
Meer dan 5 miljoen Amerikanen hebben de ziekte van Alzheimer, volgens het National Institute on Aging. De incidentie neemt toe met de leeftijd, treft één op de 10 Amerikanen van 65 jaar en ouder, en één op de drie op 85-jarige leeftijd. Wetenschappers proberen nog steeds te achterhalen wat de oorzaak is van deze progressieve en onomkeerbare hersenaandoening. Maar een hoofdverdachte is bèta-amyloïde, een kleverig eiwitfragment, of peptide, dat zich ophoopt in de hersenen, communicatie tussen hersencellen die neuronen worden genoemd, verstoren. Veel van deze schade treedt op, Ming zegt, wanneer bèta-amyloïde zich hecht aan metalen zoals ijzer of koper. Deze metalen kunnen ervoor zorgen dat bèta-amyloïde peptiden zich verkeerd vouwen en aan elkaar binden in klonten die ontstekingen en oxidatie kunnen bevorderen - een proces dat lijkt op roesten - in nabijgelegen neuronen, hen uiteindelijk vermoorden.
Eerder onderzoek door andere wetenschappers suggereert dat bietensap de zuurstoftoevoer naar de ouder wordende hersenen kan verbeteren en mogelijk de cognitieve prestaties kan verbeteren. Voortbouwend op dit werk, Ming, Darrell Cole Cerrato en collega's van de Universiteit van Zuid-Florida wilden weten of betanine, een bietenverbinding die wordt gebruikt in commerciële kleurstoffen die gemakkelijk aan metalen bindt, zou de effecten van koper op bèta-amyloïde kunnen blokkeren en, beurtelings, het verkeerd vouwen van deze peptiden en de oxidatie van neuronen te voorkomen.
Bij laboratoriumonderzoeken de onderzoekers voerden een reeks experimenten uit met 3, 5 di-tert-butylcatechol, of DTBC, een verbinding die wordt gebruikt als een modelstof voor het volgen van de chemie van oxidatie. Met behulp van zichtbare spectrofotometrie, de wetenschappers maten de oxidatieve reactie van DTBC bij blootstelling aan alleen bèta-amyloïde, beta-amyloïde gebonden aan koper, en kopergebonden bèta-amyloïde in een mengsel dat betanine bevat.
Op zichzelf, beta-amyloïde veroorzaakte weinig of geen oxidatie van DTBC. Echter, zoals verwacht, beta-amyloïde gebonden aan koper induceerde aanzienlijke DTBC-oxidatie. Maar toen betanine werd toegevoegd aan het kopergebonden bèta-amyloïde mengsel, de onderzoekers ontdekten dat de oxidatie met maar liefst 90 procent daalde, wat suggereert dat het verkeerd vouwen van de peptiden mogelijk werd onderdrukt.
"We kunnen niet zeggen dat betanine het verkeerd vouwen volledig stopt, maar we kunnen zeggen dat het oxidatie vermindert, ", zegt Cerrato. "Minder oxidatie kan tot op zekere hoogte verkeerd vouwen voorkomen, misschien zelfs tot het punt dat het de aggregatie van bèta-amyloïde peptiden vertraagt, waarvan wordt aangenomen dat het de ultieme oorzaak van de ziekte van Alzheimer is."
 Nieuwe rekentechniek lost gecomprimeerde röntgengegevens op
Nieuwe rekentechniek lost gecomprimeerde röntgengegevens op Epitaxiale antiperovskiet/perovskiet heterostructuren voor materiaalontwerp
Epitaxiale antiperovskiet/perovskiet heterostructuren voor materiaalontwerp Grammen omzetten in AMU
Grammen omzetten in AMU  Het synthetiseren van arylsulfiden uit niet-ruikende, niet-toxische verbindingen
Het synthetiseren van arylsulfiden uit niet-ruikende, niet-toxische verbindingen Middeleeuwse blauwe kleurstoffen moleculaire structuur geïdentificeerd
Middeleeuwse blauwe kleurstoffen moleculaire structuur geïdentificeerd
 Egg Drop Experiment Solutions Without Parachute
Egg Drop Experiment Solutions Without Parachute Dorian roept talloze bedreigingen op voor zuidelijke staten
Dorian roept talloze bedreigingen op voor zuidelijke staten Onderzoek toont aan dat de Falklandeilanden potentieel CO2-negatief kunnen worden
Onderzoek toont aan dat de Falklandeilanden potentieel CO2-negatief kunnen worden Biologisch afbreekbaar plastic wordt binnenkort verboden in Australië - dat is een grote overwinning voor het milieu
Biologisch afbreekbaar plastic wordt binnenkort verboden in Australië - dat is een grote overwinning voor het milieu Studie blaast 2,3 miljard jaar oude Great Oxidation Event nieuw leven in
Studie blaast 2,3 miljard jaar oude Great Oxidation Event nieuw leven in
Hoofdlijnen
- Deze 8 foto's van puppy's kunnen je helpen focussen,
- Hebben hersencellen een lipide-dubbellaag?
- Projectideeën om het menselijk spijsverteringssysteem op de middelbare school voor studenten te laten zien
- Lijst van forensische technieken
- Virussen bestrijden:codebrekers worden codeschrijvers
- Wat zijn de twee processen die ATP produceren?
- Bereken de percentages van adenine in een DNA-streng
- Twee Caribische vogelvangbomen vernoemd naar twee vrouwen met over het hoofd gezien botanische werken
- De kans op gemengd fokken tussen twee zangvogelsoorten neemt af met warmere bronnen
- Atomaire defectlijnen onderdrukken deactivering van ijzeroxidekatalysatoren
- Het veelzijdige ontwerp van de bidsprinkhaangarnalenclub inspireert geavanceerde composietmaterialen voor vliegtuigen, voetbal helmen
- Een regelbaar membraan om koolstofdioxide uit uitlaatstromen te halen

- Dennennaalden van oude kerstbomen kunnen in de toekomst worden omgezet in verf en voedselzoetstoffen

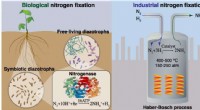
- Groenere benaderingen van stikstofbinding verkennen
 De grootste spinnen in Virginia
De grootste spinnen in Virginia 8e-graads uitvinding Science Project Ideas
8e-graads uitvinding Science Project Ideas Nieuwe dinosaurusontdekking in Zwitserland vult een gat in de evolutionaire geschiedenis van sauropoden
Nieuwe dinosaurusontdekking in Zwitserland vult een gat in de evolutionaire geschiedenis van sauropoden Klimaatverandering niet de belangrijkste oorzaak van menselijke conflicten en ontheemding in Oost-Afrika
Klimaatverandering niet de belangrijkste oorzaak van menselijke conflicten en ontheemding in Oost-Afrika Wat zijn oliezanden?
Wat zijn oliezanden?  Argentinië stelt 65 miljoen jaar oude dinosaurusreplica tentoon
Argentinië stelt 65 miljoen jaar oude dinosaurusreplica tentoon Het mechanische voordeel van Block & Tackle
Het mechanische voordeel van Block & Tackle  Het installeren van zonnepanelen op landbouwgronden maximaliseert hun efficiëntie, nieuwe studie toont
Het installeren van zonnepanelen op landbouwgronden maximaliseert hun efficiëntie, nieuwe studie toont
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | German | Dutch | Danish | Norway | Swedish |

-
Wetenschap © https://nl.scienceaq.com

