
Wetenschap
Bacteriële hechting in vitro en in silico
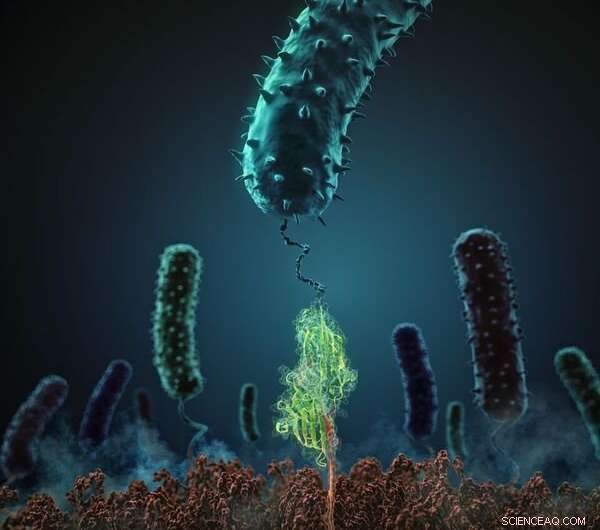
Deze afbeelding laat zien hoe de stafylokokken adhesie-eiwit (in groen) interageert met zijn verwante peptide-ligand (rood). Krediet:H. Gaub, LMU München
Ludwig-Maximilians-Universitaet (LMU) onderzoekers in München, Duitsland, hebben het fysieke mechanisme gekarakteriseerd waardoor een wijdverbreid bacterieel pathogeen zich kan hechten aan de weefsels van zijn menselijke gastheer.
Bacteriële pathogenen hebben zeer effectieve strategieën ontwikkeld waarmee ze zich kunnen hechten aan doelcellen en niches in de weefsels van hun gastheerorganismen. Ze maken zelfs gebruik van relatief onbekende natuurkundige principes, als een nieuwe studie in het tijdschrift Wetenschap demonstreert. In samenwerking met wetenschappers van de Universiteit van Illinois in Urbana-Champaign, Lukas Milles en professor Hermann Gaub van de Faculteit der Natuurkunde van de LMU hebben het mechanisme ontdekt waardoor de bacterie Staphyloccus epidermidis zo hardnekkig bindt aan gastheerweefsels. Inderdaad, het team heeft niet alleen de fysieke basis voor de interactie geïdentificeerd, maar kenmerkte ook het aanhankelijkheidsmechanisme in ongekend detail.
Deze prestatie werd mogelijk gemaakt door de nieuwe tweeledige benadering die in het onderzoek werd gebruikt. De onderzoekers gebruikten atoomkrachtmicroscopie om de bindingskracht tussen een staphylococcus-adhesie-eiwit (SdrG van Staphylococcus epidermidis) en zijn verwante ligand (fibrinogeen β) op het niveau van één molecuul in vitro te meten, en de bijdragen berekend van alle atomen die betrokken zijn bij de interactie in silico, met behulp van een bijzonder krachtige supercomputer. "Dit innovatieve paradigma levert inzichten op die voorheen onbereikbaar waren, " merkt Gaub op. Om het adhesiemechanisme te ontleden, de Blue Waters-supercomputer van de Universiteit van Illinois, met zijn 900, 000 processors een van de meest geavanceerde ter wereld, gedetailleerde moleculaire dynamica-simulaties uitgevoerd. De vasthoudendheid van de interactie verraste het team. "De mechanische bindingskracht die de componenten van een enkel complex bij elkaar houdt, bedraagt meer dan 2 nanonewton (nN). Dit is een buitengewone waarde voor een niet-covalente interactie, vergelijkbaar met de sterkte van de covalente bindingen tussen atomen, wat de meest stabiele moleculaire bindingen zijn die we kennen, ’ zegt Gaub.
De studie laat zien dat, dankzij de geometrie van de interactie, het adhesie-eiwit vormt met zijn ligand een dicht netwerk van niet-covalente waterstofbruggen. Bovendien, dit netwerk wordt gemedieerd door de peptidebindingen die de zich herhalende ruggengraat van het eiwit vormen, in plaats van de variabele zijketens die de aminozuursubeenheden differentiëren. Het grote aantal betrokken lokale interacties leidt tot een verstijving van elke waterstofbinding, wat aanleiding geeft tot wat natuurkundigen 'een coöperatieve schuifgeometrie' noemen. "Dit soort constructie is bestand tegen extreme belastingen, omdat alle individuele bindingen in één keer moeten worden verbroken om het complex te scheiden, " zoals Lukas Milles uitlegt. Het mechanisme is analoog aan de interactie tussen de vele kleine haakjes en lusjes op twee klittenband, die uiterst moeilijk te scheiden zijn wanneer ze aan tegenovergestelde uiteinden worden getrokken. "De bacterie maakt gebruik van een zeer ongebruikelijk mechanisme, die zowel uiterst ingewikkeld als zeer effectief is, en geeft de ziekteverwekker een beslissend voordeel, " zegt Gaub. Aangezien het mechanisme is gebaseerd op de peptide-ruggengraat van de op elkaar inwerkende moleculen, wat alle eiwitten gemeen hebben, dit niveau van stabiliteit kan worden bereikt in interacties met een breed spectrum aan doelen. Met andere woorden, de extreem hoge mechanische sterkte van de interactie is grotendeels onafhankelijk van zowel de aminozuursequentie van het adhesie-eiwit als de biochemische eigenschappen van het doelpeptide.
Stafylokokken zijn verantwoordelijk voor een breed scala aan infecties bij dieren en bij mensen. "Pathogene bacteriën binden zich met ongewone persistentie aan doelmoleculen op gastheercellen, en dit heeft zijn basis in fysieke principes. In de zoektocht naar manieren om invasieve infecties te blokkeren, een beter begrip van de betrokken natuurkundige principes is van vitaal belang, " zegt Hermann Gaub. Dus, de nieuwe studie legt de basis voor de ontwikkeling van nieuwe therapieën voor de behandeling van stafylokokkeninfecties.
 Nieuw biomateriaal kan plastic laminaten vervangen, sterk verminderen vervuiling
Nieuw biomateriaal kan plastic laminaten vervangen, sterk verminderen vervuiling Wetenschappers creëren chemische tuinen die kunnen worden gebruikt als botvervangende materialen
Wetenschappers creëren chemische tuinen die kunnen worden gebruikt als botvervangende materialen Zeolietkatalysatoren effenen de weg naar decentrale chemische processen
Zeolietkatalysatoren effenen de weg naar decentrale chemische processen Een manier om methaan onder milde omstandigheden direct om te zetten in methanol of azijnzuur
Een manier om methaan onder milde omstandigheden direct om te zetten in methanol of azijnzuur Hoe de pakkingsfractie van een diamantrooster te berekenen
Hoe de pakkingsfractie van een diamantrooster te berekenen
 De effecten van stortplaatsen op het milieu
De effecten van stortplaatsen op het milieu Zwemmer wordt geconfronteerd met haaien, enorme vuilnisbelt op record oversteek over de Stille Oceaan
Zwemmer wordt geconfronteerd met haaien, enorme vuilnisbelt op record oversteek over de Stille Oceaan De oorsprong en evolutie van het leven:het bewijs van vroege levenssporen opnieuw onderzoeken
De oorsprong en evolutie van het leven:het bewijs van vroege levenssporen opnieuw onderzoeken Enquête onthult een laag bewustzijn van vulkanische gevaren in Australië
Enquête onthult een laag bewustzijn van vulkanische gevaren in Australië Alternatief vlees onderdrukt de afhankelijkheid van grazende dierlijke bronnen niet
Alternatief vlees onderdrukt de afhankelijkheid van grazende dierlijke bronnen niet
Hoofdlijnen
- Wat zijn enkele kenmerken van DNA?
- In het wild als ecologisch uitgestorven beschouwd, Birmese sterschildpadpopulatie is gegroeid tot meer dan 14, 000 personen
- Met uitsterven bedreigde mus in Centraal-Florida die in het wild waarschijnlijk niet zal overleven
- Hebben alle mensen een uniek genotype en fenotype?
- Effecten van de microscoop op Science
- Waarom het uitsterven van parasieten een probleem kan zijn voor bedreigde woylies
- Virussen bestrijden:codebrekers worden codeschrijvers
- Daling van huismus in verband met luchtvervuiling en slechte voeding
- Onderzoek toont aan dat plantengroeiregulatoren gunstig kunnen zijn voor de vestiging van uien, productie
- Zwemmende microbots kunnen ziekteverwekkende bacteriën uit water verwijderen

- Virtuele bibliotheek van 1 miljoen nieuwe macrolide-steigers kan de ontdekking van geneesmiddelen helpen versnellen

- Verbetering van de kristalgroei met behulp van polyelektrolytoplossingen en afschuifstroming
- Zelfherstellend materiaal kan zichzelf opbouwen uit koolstof in de lucht

- Wat gebeurt er als u zwembadchloor mengt en vloeistof breekt?

 Welk type vulkaan wordt niet geassocieerd met een plaatgrens
Welk type vulkaan wordt niet geassocieerd met een plaatgrens  Qualcomm fleurt 5G-toekomst op met modem antenne module nieuws
Qualcomm fleurt 5G-toekomst op met modem antenne module nieuws Waterbedden simuleren gewichtloosheid om skinsuits te helpen rugpijn in de ruimte te bestrijden
Waterbedden simuleren gewichtloosheid om skinsuits te helpen rugpijn in de ruimte te bestrijden Deep learning verandert smartphonemicroscopen in apparaten van laboratoriumkwaliteit
Deep learning verandert smartphonemicroscopen in apparaten van laboratoriumkwaliteit Mensen migreren eerder uit kleine steden dan uit grote
Mensen migreren eerder uit kleine steden dan uit grote Door de natuur te vernederen, schaadt de mensheid zichzelf, VN-rapport waarschuwt
Door de natuur te vernederen, schaadt de mensheid zichzelf, VN-rapport waarschuwt Naties onder druk gezet om urgente bedreigingen aan te pakken tijdens VN-klimaatbesprekingen
Naties onder druk gezet om urgente bedreigingen aan te pakken tijdens VN-klimaatbesprekingen Weiden verslaan struiken als het gaat om het opslaan van koolstof
Weiden verslaan struiken als het gaat om het opslaan van koolstof
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

