
Wetenschap
Moleculaire structuur van anti-verouderingseiwit alfa Klothos onthuld

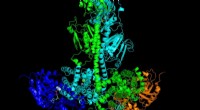
UT Southwestern-onderzoekers hebben geholpen de moleculaire structuur van alfa Klotho (a-Klotho) te onthullen, het zogenaamde “anti-aging” eiwit. Krediet:UT Southwestern Medical Center
Onderzoekers van het Charles en Jane Pak Center for Mineral Metabolism and Clinical Research van de UT Southwestern en de afdeling Nefrologie van Interne Geneeskunde hebben onlangs werk gepubliceerd in Natuur dat onthult de moleculaire structuur van het zogenaamde "anti-aging" eiwit alfa Klotho (a-Klotho) en hoe het een hormonaal signaal doorgeeft dat een verscheidenheid aan biologische processen regelt. Het onderzoek werd uitgevoerd in samenwerking met wetenschappers van de New York University School of Medicine en de Wenzhou Medical University in China.
Studies aan UTSW twee decennia geleden door Dr. Makoto Kuro-o, hoogleraar Pathologie, toonde aan dat muizen zonder a-Klotho of het hormoon FGF23 leden aan voortijdig en meervoudig orgaanfalen, evenals aan andere aandoeningen, waaronder vroeg optredende hart- en vaatziekten, kanker, en cognitieve achteruitgang. Omdat defecten in a-Klotho leiden tot symptomen die worden gezien bij veroudering, onderzoekers concludeerden dat a-Klotho veroudering onderdrukt, wat leidde tot grote interesse in hoe het a-Klotho-eiwit zou kunnen samenwerken met het hormoon FGF23 om hun rol te vervullen.
a-Klotho kan op het oppervlak van een cel voorkomen of uit de cel worden vrijgegeven en in lichaamsvloeistoffen circuleren, inclusief het bloed, als oplosbaar a-Klotho. Vroeger en algemeen werd aangenomen dat de celgebonden vorm en de circulerende vorm van a-Klotho totaal verschillende functies hadden.
"Het a-Klotho-gen [toen nog Klotho genoemd] werd in 1997 gekloond door Dr. Kuro-o, kort voordat hij hier werd gerekruteerd, en tijdens zijn ambtstermijn bij UT Southwestern heeft hij het meest baanbrekende werk op dit gebied uitgevoerd, " zei Dr. Orson Moe, directeur van het Pak Center. "Het gen beschermt tegen vele ziekten, waaronder hart- en vaatziekten, kanker, suikerziekte, veroudering, neurodegeneratie, en nierziekte. De structuur van het a-Klotho-eiwit en hoe het eiwit functioneert, echter, grotendeels bleef een mysterie tot dit huidige werk."
Door een eerste blik te werpen op de structuur van het eiwitcomplex dat FGF23 en zijn co-receptoren omvat, de FGF-receptor en a-Klotho, de meest recente studie daagt de lang aanvaarde overtuiging uit dat alleen de celgebonden vorm van aKlotho kan dienen als een receptor voor FGF23 en daarom dat de werking van FGF23 beperkt is tot weefsels met de celgebonden vorm.
Studie auteurs omvatten Dr. Moe, Hoogleraar Interne Geneeskunde en Fysiologie, en Dr. Ming Chang Hu, Universitair hoofddocent interne geneeskunde en kindergeneeskunde. Dr. Moe bekleedt de Charles Pak Distinguished Chair in Mineral Metabolism, en de Donald W. Seldin Professorship in Clinical Investigation. Dr. Hu bekleedt het Makoto Kuro-o hoogleraarschap in bot- en nieronderzoek.
Een van de belangrijkste, paradigmaveranderende bevindingen onthuld door het oplossen van de eiwitcomplexstructuur is dat de circulerende vorm van oplosbaar a-Klotho daadwerkelijk kan dienen als een co-receptor voor FGF23. Dus, de oplosbare vorm van a-Klotho kan naar elke cel in het lichaam gaan en fungeren als een co-receptor voor FGF23, waardoor elke cel een mogelijk doelwit van FGF23 wordt, die een grote paradigmaverschuiving vertegenwoordigen.
"a-Klotho-onderzoekers bij kanker, veroudering, neurologisch, cardiovasculair, en nierziekte zullen profiteren van dit onderzoek, "Zei Dr. Moe. "De kennis van de structuur van het eiwit, samen met zijn moleculaire bindingspartners, zal ons in staat stellen om het begrip van hoe a-Klotho werkt enorm te vergroten en ook hoe we het beste therapeutische strategieën en nieuwe middelen kunnen ontwerpen die de interactie en signalering van FGF23-a-Klotho kunnen activeren of blokkeren, indien nodig."
Gezamenlijk geleid door NYU School of Medicine structureel bioloog Dr. Moosa Mohammadi, het onderzoek omvatte onderzoekers van UTSW, het op de Rockefeller University gebaseerde New York Structural Biology Center, en Wenzhou Medische Universiteit.
De studie levert bewijs voor hoe FGF23 signalen naar cellen stuurt door een complex te vormen met a-Klotho en de twee andere moleculaire partners. Gemaakt door botcellen, het FGF23-hormoon reist via de bloedbaan naar cellen in alle organen, waar het veel aspecten van het mineraalmetabolisme regelt. Abnormale FGF23-spiegels worden in veel ziektetoestanden aangetroffen. Bij chronische nierziekte, bijvoorbeeld, Aangenomen wordt dat hoge FGF23-spiegels veel van de complicaties en sterfgevallen van de ziekte veroorzaken.
De onderzoekers zeggen dat hun bevindingen ook nieuw licht werpen op hoe nierziekte leidt tot een abnormale verdikking van hartspierweefsel, hypertrofie genaamd. wat een belangrijke doodsoorzaak is bij mensen met een nierziekte veroorzaakt door hoge bloeddruk, suikerziekte, en andere ziekten. Wanneer beschadigde niertubuli niet langer fosfaat in de urine kunnen elimineren, FGF23 stijgt, aanvankelijk als een poging om het fosfaat in het bloed onder controle te houden. Met tijd, FGF23 kan tot schadelijke niveaus stijgen.
Een heersende hypothese was dat zeer hoge niveaus van FGF23 hypertrofie in het hart veroorzaken. Maar de theorie bleef controversieel omdat hartweefsel geen a-Klotho heeft, die aanwezig moet zijn als FGF23 moet signaleren. De laatste bevindingen geven aan dat a-Klotho via de bloedbaan kan worden "afgeleverd" aan organen waar het normaal niet aanwezig is. Dit zou mogelijk programma's voor de ontwikkeling van geneesmiddelen voor nierziekte kunnen lanceren, aldus de onderzoekers.
"The solution of this protein structure will guide many future studies, " Dr. Moe said. "There are numerous diseases that involve a-Klotho deficiency. Replenishment of a-Klotho by either recombinant protein injection or drugs that increase a patient's own a-Klotho will have potential therapeutic implications for neurologic, metabool, cardiovascular and kidney disease, and cancer."
 Door bleekmiddel geïnduceerde transformatie voor vochtbestendige luchtfilters
Door bleekmiddel geïnduceerde transformatie voor vochtbestendige luchtfilters Reparatie en regeneratie van perifere zenuwen mogelijk met dubbele polymeer hydrogellijm
Reparatie en regeneratie van perifere zenuwen mogelijk met dubbele polymeer hydrogellijm Mobiele handen om deuren te openen in gezondheidsonderzoek, medicijn ontwerp, en bio-engineering
Mobiele handen om deuren te openen in gezondheidsonderzoek, medicijn ontwerp, en bio-engineering Een onwaarschijnlijk huwelijk tussen oxiden
Een onwaarschijnlijk huwelijk tussen oxiden Screentest voor vingerafdrukken werkt op levenden en overledenen
Screentest voor vingerafdrukken werkt op levenden en overledenen
 Huizen mogen niet worden verlaten na een groot nucleair ongeval
Huizen mogen niet worden verlaten na een groot nucleair ongeval NASA-satellieten zien tropische cycloon Enawo door centraal Madagaskar bewegen
NASA-satellieten zien tropische cycloon Enawo door centraal Madagaskar bewegen Venetië komt weer boven water na een week van recordoverstromingen
Venetië komt weer boven water na een week van recordoverstromingen Ecuador Amazon-stam wint eerste overwinning tegen oliemaatschappijen
Ecuador Amazon-stam wint eerste overwinning tegen oliemaatschappijen "Dolphin Science Projects
"Dolphin Science Projects
Hoofdlijnen
- Stappen voor het traceren van een plant:zaadverspreiding volgen met behulp van chloroplast-DNA
- Krachten van spinnengif onderzocht in VR-game
- Tandwortelpulp wordt een rijke bron van stamcellen
- Probeer deze 5 dagelijkse gewoonten om je leven dit jaar te verbeteren
- Wetenschappers stellen universele wetten voor over de grootte en biologie van plantenzaden
- Wat is de levensduur van huidcellen?
- Wat zijn chromatine en chromosomen?
- Biohazard-afval verwijderen
- Hoe slapende listeria zich in cellen verbergt
- Niet-vervuilend membraan voor bovenkleding

- Wetenschappers maken biologisch afbreekbare microbeads van cellulose
- Het maken van nepvlees roept vragen op over de gezondheid, ethiek en duurzaamheid voor een voormalige slager

- Onderzoekers lossen eiwitstructuur op die verband houdt met erfelijke netvliesaandoeningen
- Gemodificeerde peptiden kunnen de groei en ontwikkeling van planten stimuleren
 Gegevens opslaan in DNA brengt de natuur in het digitale universum
Gegevens opslaan in DNA brengt de natuur in het digitale universum NASA vindt ex-tropische cycloon Esther terug landinwaarts
NASA vindt ex-tropische cycloon Esther terug landinwaarts Big data op social media platform onthult positieve gezichtsuitdrukkingen van vrouwelijke bezoekers in stadsbossen
Big data op social media platform onthult positieve gezichtsuitdrukkingen van vrouwelijke bezoekers in stadsbossen Onderzoekers onderzoeken hoe de subtiele keuze van synoniemen je de hand kan doen schudden voor welke politieke partij je steunt
Onderzoekers onderzoeken hoe de subtiele keuze van synoniemen je de hand kan doen schudden voor welke politieke partij je steunt Embraer tekent overeenkomst om commerciële divisie te verkopen aan Boeing
Embraer tekent overeenkomst om commerciële divisie te verkopen aan Boeing Fotosynthese versus cellulaire ademhaling in elektronenstroom
Fotosynthese versus cellulaire ademhaling in elektronenstroom Schelpen en grapefruits inspireren het eerste vervaardigde niet-snijbare materiaal
Schelpen en grapefruits inspireren het eerste vervaardigde niet-snijbare materiaal Nieuwe benadering van energiestrategie zorgt voor onzekerheid
Nieuwe benadering van energiestrategie zorgt voor onzekerheid
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Swedish | German | Dutch | Danish | Norway | Portuguese |

-
Wetenschap © https://nl.scienceaq.com

