
Wetenschap
Fluorescerende sondes om cellulaire activiteit te bestuderen
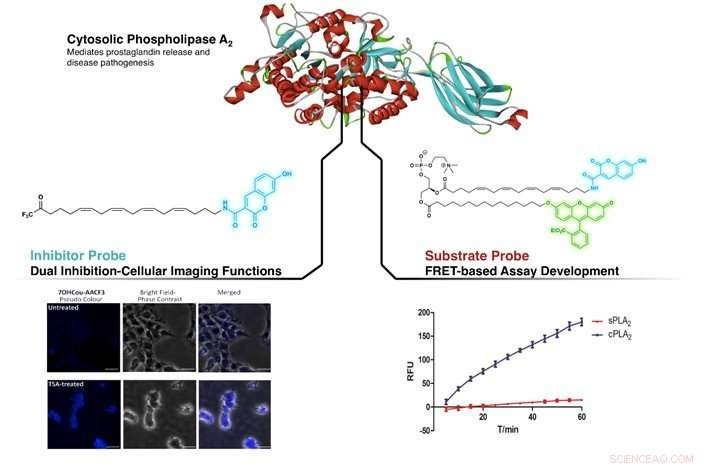
Figuur toont de targeting van cPLA2 door de nieuw ontworpen remmer en substraatsonde. Links:Identificatie van verschillen in cPLA2-niveau in onbehandeld en Trichostatine A (TSA, een remmerverbinding)-behandelde SHSY5Y-cellen. Rechts:demonstreren van hogere selectiviteit voor cPLA2 tegen sPLA2 (een ander lid van de fosfolipase A2-familie) door FRET-gebaseerde test met behulp van de substraatsonde. Krediet:NG Cheng Yang, CAO Xujun
NUS-chemici hebben onlangs selectieve probes ontwikkeld voor cytosolische fosfolipase A2 (cPLA2) om enzymniveaus en activiteit te bepalen.
cPLA2 is een belangrijk enzym dat veel wordt gebruikt bij het reguleren van ontstekingsreacties in het lichaam. Het heeft veel belangstelling gekregen op medisch gebied, met toenemende banden van zijn betrokkenheid bij inflammatoire en neurologische ziekten zoals de ziekte van Alzheimer en multiple sclerose. Het vermogen om cPLA2 in biologische systemen in beeld te brengen en correct te identificeren, is belangrijk voor het begrijpen van de mechanistische routes die bij deze ziekten betrokken zijn. Een team onder leiding van Prof LAM Yulin van de afdeling Chemie, NUS heeft enkele fluorescerende verbindingen ontdekt die cPLA2 kunnen afbeelden. Deze omvatten een remmer (verbinding die de enzymactiviteit vermindert) en een substraat (verbinding waarop het enzym inwerkt) die fluorescentie vertonen.
Door de structuur van een bekende remmer van cPLA2 na te bootsen, arachidonyltrifluormethylketon (AACOCF3), de onderzoeksgroep heeft met succes een fluorescerende organische kleurstof (coumarine) bevestigd aan het koolstofketenuiteinde van AACOCF3. Hierdoor ontstond een fluorogene vorm van AACOCF3 die zijn natieve remmende activiteit tegen cPLA2 behield. Voorlopige studies uitgevoerd op de nieuw ontworpen verbinding toonden aan dat het in staat is om onderscheid te maken tussen cellen die verschillende niveaus van cPLA2 bevatten. gelijktijdig, deze nieuw ontwikkelde sonde was in staat om cPLA2 te remmen het verstrekken van een dubbele rol van beeldvorming en remming. Hierdoor kunnen biochemici het enzym direct op cellulair niveau detecteren terwijl ze een beoogde biologische respons bewerkstelligen.
Aangemoedigd door deze resultaten, de onderzoeksgroep breidde hun studies uit door een andere sonde te ontwikkelen om cPLA2-activiteit te meten. De conventionele bepaling van cPLA2-activiteit maakt gebruik van een radioactieve verbinding als substraat. Echter, het gebruik van dergelijke testen is zeer ongewenst vanwege de gevaren die radioactieve materialen omringen. Om dit probleem te omzeilen, verschillende calorimetrische en fluorogene testkits voor het meten van cPLA2-activiteit zijn nu in de handel verkrijgbaar. Echter, deze testen kunnen ook andere enzymen in de PLA2-familie detecteren en zijn niet alleen selectief voor cPLA2. Het zou handig zijn om een alternatieve sonde te hebben, die specifiek gericht is op cPLA2.
Door een vergelijkbare aanpak te volgen, fluorogene coumarine en fluoresceïne (een andere fluorescerende organische kleurstof) groepen werden gehecht aan fosfatidylcholine (een substraat van cPLA2). Dit veroorzaakt een niet-stralende interne energieoverdracht tussen de ene kleurstof naar de andere wanneer het lichtgevoelige deel wordt bestraald op zijn excitatiegolflengte; een fenomeen dat bekend staat als Förster-resonantie-energieoverdracht (FRET). Deze nieuwe substraatprobe bleek zeer selectief te zijn voor cPLA2, zonder verlies van natieve activiteit en geschikt voor screeningstests voor remmers.
De groep onderzoekt momenteel de effecten van het hechten van fluorescerende chemische verbindingen van verschillende kleuren aan zowel de remmer- als substraatsondes om hun toepassingen te verbreden.
 Is een ecosysteem groter of kleiner dan een bioom?
Is een ecosysteem groter of kleiner dan een bioom?  Het bouwen van een modelzodenhuis voor een schoolproject
Het bouwen van een modelzodenhuis voor een schoolproject Door bakken handiger te maken, worden de recycling- en composteringspercentages verhoogd
Door bakken handiger te maken, worden de recycling- en composteringspercentages verhoogd Verbetering van de transparantie van geïntegreerde beoordelingsmodellen met betrekking tot klimaatverandering
Verbetering van de transparantie van geïntegreerde beoordelingsmodellen met betrekking tot klimaatverandering Zeewier Feiten voor Kids
Zeewier Feiten voor Kids
Hoofdlijnen
- Hoe een tRNA-sequentie uit een DNA-sequentie te krijgen
- Zijn voedingsmiddelen gemaakt met behulp van biotechnologie veilig om te eten?
- Wat is opsomming in de microbiologie?
- Alle informatie die nodig is om proteïnen te maken is gecodeerd in DNA door wat?
- Zelfvernietiging van muggen
- Nieuwe studie brengt prioriteitsgebieden over de hele wereld in kaart om zoogdieren te beschermen
- Algen kunnen planeet voeden en voeden met behulp van nieuwe hightech tool
- Hoe MRNA naar TRNA
- Thuis op het strand:Antelope krijgt nieuwe opgravingen in New Orleans
- Ontwikkeling van een ultrasnel biomimetisch snapping hydrogelmateriaal met twee gradiënten
- Kirigami kan terahertz-stralen in realtime ronddraaien om in biologisch weefsel te kijken

- Complex leven is ontstaan uit de toevallige koppeling van kleine moleculen

- Goedkoop organisch materiaal geeft veilige batterijen een langere levensduur
- Grote doorbraak in de productie van rode bloedcellen
 Wil je meer vrouwen in topposities? Bied ze meer flexibiliteit op het werk
Wil je meer vrouwen in topposities? Bied ze meer flexibiliteit op het werk Database met kristallijne structuren biedt recepten voor niet-deskundige koks die nieuwe materialen bereiden
Database met kristallijne structuren biedt recepten voor niet-deskundige koks die nieuwe materialen bereiden De beste Ivy League-scholen voor wiskunde en wetenschappen
De beste Ivy League-scholen voor wiskunde en wetenschappen Hoe de recessie van het coronavirus servicemedewerkers in gevaar brengt
Hoe de recessie van het coronavirus servicemedewerkers in gevaar brengt Synthese van pure enkele laag blauwe fosfor kan nuttig zijn voor halfgeleiders
Synthese van pure enkele laag blauwe fosfor kan nuttig zijn voor halfgeleiders Politieagenten vertellen over op het lichaam gedragen camera's in een post-Ferguson-tijdperk
Politieagenten vertellen over op het lichaam gedragen camera's in een post-Ferguson-tijdperk Bio-ondersteunde nanofotokatalysator voor waterstofproductie
Bio-ondersteunde nanofotokatalysator voor waterstofproductie BMW is van plan om de Chinese joint venture over te nemen
BMW is van plan om de Chinese joint venture over te nemen
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway | French |

-
Wetenschap © https://nl.scienceaq.com

