
Wetenschap
Het onzichtbare spotten
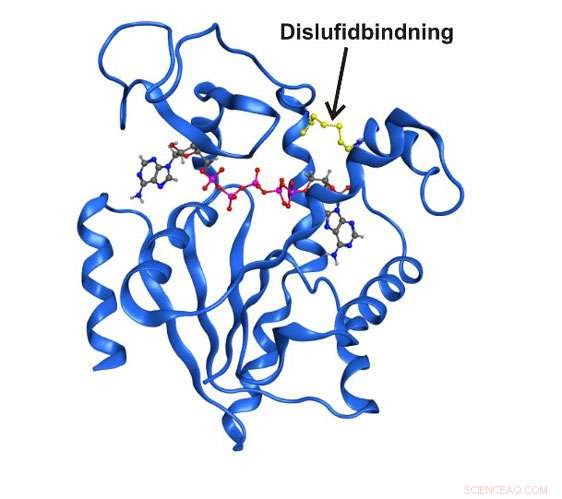
Röntgenstructuur met hoge resolutie van het enzym adenylaatkinase gevangen in een tijdelijke structurele toestand door een covalente disulfidebinding. Krediet:Umea University
Chemici van de Universiteit van Umeå zijn erin geslaagd structuren en functies van een voorbijgaande enzymtoestand in kaart te brengen. Door het enzym adenylaatkinase te modificeren, onderzoekers konden het molecuul isoleren en bestuderen met behulp van de kwantitatieve technieken röntgenkristallografie en nucleaire magnetische resonantie (NMR) spectroscopie. De resultaten zijn gepubliceerd in het tijdschrift PNAS .
"We zijn nu een stap dichter bij een algemeen begrip van hoe enzymen werken. Dit is van vitaal belang voor toekomstige ontwerpen van nieuwe enzymen in biotechnologische toepassingen, " zegt Magnus Wolf-Watz, universitair hoofddocent bij de afdeling Scheikunde aan de Universiteit van Umeå.
Het biologische leven is afhankelijk van een groot aantal cellulaire, chemische reacties die vaak extreem langzaam zijn en maanden of jaren in beslag kunnen nemen. Om chemische en biologische tijdschalen te matchen, chemische reacties worden versneld in cellen met het gebruik van enzymen als efficiënte biokatalysatoren.
In het laatste decennium van onderzoek is duidelijk gemaakt dat enzymstructuren die slechts kort en tijdelijk bestaan, volledig essentieel kunnen zijn voor de katalytische functie. Tot dusver, het was niet mogelijk om deze toestanden in detail te bestuderen vanwege het simpele feit dat ze onzichtbaar zijn voor traditionele spectroscopische technieken. Nutsvoorzieningen, onderzoekers van de afdeling Scheikunde van de Universiteit van Umeå in Zweden zijn erin geslaagd een voorbijgaande toestand vast te leggen die centraal staat in de functie in het essentiële enzym adenylaatkinase. De korte termijn toestand was mogelijk te verrijken door twee aminozuren in het enzym uit te wisselen met het reactieve aminozuur cysteïne.
"Het is de eerste keer dat iemand erin is geslaagd om een voorbijgaande enzymtoestand direct te bestuderen met behulp van spectroscopische en kwantitatieve technieken. Met het gebruik van onze methoden, we waren in staat om zowel de structuur als de functie van het enzym in de specifieke voorbijgaande fase in detail te beschrijven, " zegt Magnus Wolf-Watz, die het onderzoek leidde samen met postdoc Michael Kovermann, die nu een groepsleiding heeft aan de universiteit van Konstanz in Duitsland.
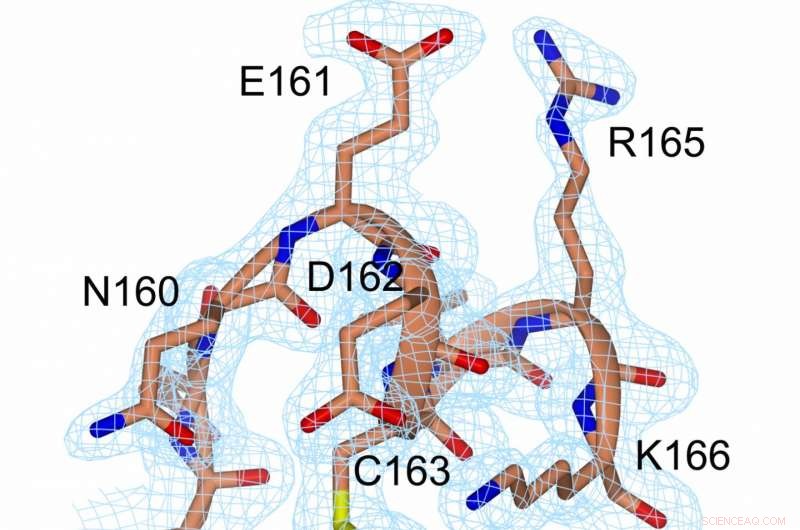
Een weergave van de elektronendichtheid bij de disulfidebinding (geel, tussen C56 en C163) en in de directe omgeving. Krediet:Prof. Michael Kovermann, Universiteit van Konstanz
De resultaten gaven aan dat de functie in één enzym volledig afhankelijk is van zijn inherente dynamiek, en zonder dynamiek zou het enzym onbruikbaar worden. Verder, het bleek dat de transiënte toestand zijn substraatmoleculen veel sterker bond dan de natuurlijke eiwitten. De resultaten gaven ons verdere aanwijzingen over hoe enzymen reacties kunnen versnellen met zo'n ongelooflijke specificiteit en werkzaamheid. De hele tijd, de methode die we hebben ontwikkeld, kan over het algemeen nuttig zijn in studies van andere enzymen."
Het NMR-team van Magnus Wolf Watz heeft aan het onderzoek samengewerkt met de röntgenkristallografen Uwe H. Sauer en Elisabeth Sauer-Eriksson.
"We hebben een langdurige en zeer productieve samenwerking gehad. Dit is een goed voorbeeld van hoe belangrijk de samenwerkingssfeer op Umeå University is, en hoe we het in de toekomst moeten koesteren en verder ontwikkelen, ", zegt Magnus Wolf-Watz.
 Galvaniseren levert hoge energie, krachtige batterijen
Galvaniseren levert hoge energie, krachtige batterijen Anorganische perovskietabsorbers voor gebruik in dunnefilmzonnecellen
Anorganische perovskietabsorbers voor gebruik in dunnefilmzonnecellen Hoe groen is jouw waterdichte jas?
Hoe groen is jouw waterdichte jas? Draagbare chemiekit maakt het mogelijk om de zoetheid van bushfood ter plaatse te testen
Draagbare chemiekit maakt het mogelijk om de zoetheid van bushfood ter plaatse te testen Baanbrekende studie van celsignalering belooft veel voor immuunonderzoek en daarbuiten
Baanbrekende studie van celsignalering belooft veel voor immuunonderzoek en daarbuiten
Hoofdlijnen
- Je lichaam aan: een hittegolf
- Brandende chili houdt olifanten op afstand, nieuwe studie vondsten
- Hoe werkt het plasmamembraan Homeostasis?
- Tropische diversiteit wortelt in relaties tussen schimmels en zaden
- Studie onderzoekt obesitas en reproductieve status van dierentuinolifanten
- Vooruitgang bereikt in droge conservering van spermacellen van zoogdieren
- Deskundigen adviseren om benchmarking te gebruiken om bedrijven met een hoog antibioticagebruik te identificeren
- Wat is het belang van virtual reality voor artsen en chirurgen?
- Graslandmussen constant op zoek naar een mooier huis
- Een weg om defecten tijdens additive manufacturing te vermijden

- Nieuw proces van bacteriën en algen kan helpen om het Britse leger koolstofarm te maken

- Het pad verlichten naar het recyclen van koolstofdioxide
- Hoe molaire oplosbaarheid te berekenen uit KSP?

- Onderzoekers creëren een eiwitmat die vervuiling kan absorberen

 Onderzoek geeft nieuw inzicht in het kapitaliseren van momentumbeleggen
Onderzoek geeft nieuw inzicht in het kapitaliseren van momentumbeleggen Waarom DNA de meest gunstige moleculen is voor genetisch materiaal en hoe RNA zich verhoudt tot deze Respect
Waarom DNA de meest gunstige moleculen is voor genetisch materiaal en hoe RNA zich verhoudt tot deze Respect Amazon wint schorsing van $ 10 miljard JEDI-contract met Microsoft
Amazon wint schorsing van $ 10 miljard JEDI-contract met Microsoft Menselijk gedrag moet worden meegenomen in analyses van klimaatverandering
Menselijk gedrag moet worden meegenomen in analyses van klimaatverandering Rover-bevindingen wijzen op gelaagd meer op het oude Mars
Rover-bevindingen wijzen op gelaagd meer op het oude Mars Hoe snel loopt een tijger?
Hoe snel loopt een tijger?  Veiligheidsangsten over Boeing 737 MAX houden Amerikaanse passagiers in de greep
Veiligheidsangsten over Boeing 737 MAX houden Amerikaanse passagiers in de greep Hoe het stadsontwerp van Teotihuacan werd verloren en gevonden
Hoe het stadsontwerp van Teotihuacan werd verloren en gevonden
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

