
Wetenschap
Moleculaire tags laten zien hoe beschadigde lysosomen worden geselecteerd en gemarkeerd voor verwijdering
Lysosomen zijn membraangebonden organellen die hydrolytische enzymen bevatten die een verscheidenheid aan moleculen afbreken, waaronder eiwitten, lipiden en koolhydraten. Lysosomen zijn essentieel voor het behoud van de cellulaire homeostase, maar ze kunnen ook gevaarlijk zijn als ze scheuren, waardoor hun inhoud in het cytoplasma vrijkomt. Om dit te voorkomen beschikken cellen over een aantal mechanismen die ervoor zorgen dat beschadigde lysosomen snel worden geïdentificeerd en verwijderd.
Een van de belangrijkste mechanismen voor het selecteren van beschadigde lysosomen voor klaring is het proces van ubiquitinatie. Ubiquitine is een klein eiwit dat aan andere eiwitten kan worden gehecht om ze te markeren voor afbraak. Wanneer een lysosoom beschadigd is, worden ubiquitineligasen naar de plaats van de schade gerekruteerd en hechten ze ubiquitinemoleculen aan het lysosomale membraan. Dit markeert het lysosoom voor herkenning door autofagiereceptoren, dit zijn eiwitten die binden aan ubiquitine en zich richten op het lysosoom voor aflevering aan het autofagosoom, een dubbelmembraanblaasje dat samensmelt met het lysosoom om de inhoud af te leveren voor afbraak.
In een recente studie gebruikten onderzoekers van de Universiteit van Californië, San Francisco moleculaire tags om het lot van beschadigde lysosomen in cellen te volgen. Ze ontdekten dat ubiquitinatie niet het enige mechanisme is dat beschadigde lysosomen kan markeren voor klaring. Ze identificeerden ook een aantal andere moleculaire tags die kunnen worden gebruikt om beschadigde lysosomen te selecteren, waaronder:
* HMGB1: HMGB1 is een eiwit dat vrijkomt uit de kern wanneer cellen onder stress staan. HMGB1 kan binden aan het lysosomale membraan en autofagie-receptoren rekruteren.
* LC3: LC3 is een eiwit dat betrokken is bij de vorming van autofagosomen. LC3 kan ook binden aan het lysosomale membraan en autofagie-receptoren rekruteren.
* p62: p62 is een eiwit dat betrokken is bij de aggregatie van beschadigde eiwitten. p62 kan binden aan het lysosomale membraan en autofagie-receptoren rekruteren.
De onderzoekers ontdekten dat deze moleculaire tags samenwerken om ervoor te zorgen dat beschadigde lysosomen snel worden geïdentificeerd en uit cellen worden verwijderd. Dit proces is essentieel voor het handhaven van de cellulaire homeostase en het voorkomen van de ontwikkeling van lysosomale stapelingsziekten.
Implicaties voor lysosomale stapelingsziekten
Lysosomale stapelingsziekten zijn een groep genetische aandoeningen die worden veroorzaakt door mutaties in genen die coderen voor eiwitten die betrokken zijn bij de lysosomale functie. Deze mutaties leiden tot de ophoping van onverteerd materiaal in lysosomen, wat cellen en weefsels kan beschadigen. Lysosomale stapelingsziekten zijn vaak dodelijk en er bestaat momenteel geen remedie.
Het hierboven beschreven onderzoek levert nieuwe inzichten op in de mechanismen die cellen gebruiken om beschadigde lysosomen te selecteren en te verwijderen. Deze kennis zou kunnen leiden tot de ontwikkeling van nieuwe therapieën voor lysosomale stapelingsziekten. Het zou bijvoorbeeld mogelijk kunnen zijn om medicijnen te ontwikkelen die de ubiquitinatie van lysosomen remmen of die de binding van autofagiereceptoren aan lysosomen blokkeren. Deze medicijnen zouden kunnen helpen de ophoping van onverteerd materiaal in lysosomen te voorkomen en de progressie van lysosomale stapelingsziekten te vertragen.
 Onderzoekers onthullen een nieuwe digitale tweeling voor nauwkeurige realtime analyse van de productie van composietmaterialen
Onderzoekers onthullen een nieuwe digitale tweeling voor nauwkeurige realtime analyse van de productie van composietmaterialen  Wetenschappers observeren hoe potentiële kankerbehandeling reageert in een enkele cel
Wetenschappers observeren hoe potentiële kankerbehandeling reageert in een enkele cel Nieuwe stafylokokvirulentiefactor
Nieuwe stafylokokvirulentiefactor Warmtevriendelijke microben bieden een efficiënte manier om plastic biologisch af te breken
Warmtevriendelijke microben bieden een efficiënte manier om plastic biologisch af te breken Industriële verbinding krijgt milieuvriendelijke reactie
Industriële verbinding krijgt milieuvriendelijke reactie
Hoofdlijnen
- Is evolutie intelligenter dan we dachten?
- Hoe eiwitten hun plaats in de cel vinden
- Schaatsenrijders illustreren evolutionaire processen
- Bestaat er echt een ‘mama’-gen bij vrouwen?
- 'Wat als er een stoere Barbie bestond?' Barbie's genderpolitiek onderzocht
- Verschillen tussen codering en sjabloondraden
- Bladeren, grazen, paren:voedsel en gezelschap helpen dieren in gevangenschap
- Bijen gebruiken onzichtbare warmtepatronen om bloemen te kiezen
- Nieuwe studie onderzoekt ATP-synthase in zure toestand om te onthullen hoe het enzym functioneert
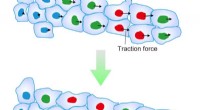
- Ontdekking van een mechanisme om de richting van collectieve celmigratie te bepalen
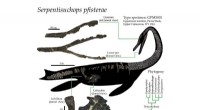
- De in 1995 opgegraven Plesiosaurus bleek een langnekkig zeereptiel te zijn
- Australische soorten hebben een onafhankelijke kampioen nodig

- Tsjaad breidt belangrijk natuurgebied in nationaal park uit

- Zieke zeeleeuwen gespot langs de kust van Ventura County

 Mieren offeren hun koloniegenoten op als onderdeel van een dodelijke desinfectie
Mieren offeren hun koloniegenoten op als onderdeel van een dodelijke desinfectie Leren over liefde via online dating
Leren over liefde via online dating Documenten tonen aan dat Facebook gebruikersgegevens gebruikte als concurrentiewapen (update)
Documenten tonen aan dat Facebook gebruikersgegevens gebruikte als concurrentiewapen (update) Hybride elektro-biosysteem upcyclet koolstofdioxide tot energierijke verbindingen met lange ketens
Hybride elektro-biosysteem upcyclet koolstofdioxide tot energierijke verbindingen met lange ketens Voorjaar 2020 Arctisch ozongat waarschijnlijk veroorzaakt door recordhoge oppervlaktetemperaturen in het noorden van de Stille Oceaan
Voorjaar 2020 Arctisch ozongat waarschijnlijk veroorzaakt door recordhoge oppervlaktetemperaturen in het noorden van de Stille Oceaan UM-analyse daagt U.S. Postal Service-milieuonderzoek voor elektrische voertuigen uit
UM-analyse daagt U.S. Postal Service-milieuonderzoek voor elektrische voertuigen uit Hoe de Northern Lights
Hoe de Northern Lights Onderzoekers meten effecten van congestie op de toegang tot banen met de auto
Onderzoekers meten effecten van congestie op de toegang tot banen met de auto
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

