
Wetenschap
Onderzoekers ontdekken details over hoe bacteriën beschermende barrières bouwen, wat nieuwe antibiotica kan opleveren
Yale-onderzoekers hebben nieuwe details ontdekt over hoe bacteriën zoals E. coli hun beschermende barrières opbouwen, wat de ontwikkeling van nieuwe antibiotica zal beïnvloeden.
Antibioticaresistente bacteriën vormen een groeiend probleem als het gaat om de bestrijding van infecties. Vooral bacteriën met een extra beschermende laag op hun celwanden (een type dat bekend staat als 'Gram-negatief', verwijzend naar de kleuringsmethode die wordt gebruikt om de bacterie te identificeren) zijn lastig te bestrijden.
Yale-onderzoekers hebben vooruitgang geboekt in het begrijpen hoe bacteriën deze beschermende laag genereren door een nieuwe studie die extra nuance aan het licht brengt – en aanvullende doelen voor de ontwikkeling van nieuwe antibiotica.
Hun bevindingen werden op 18 april gepubliceerd in de Proceedings of the National Academy of Sciences .
Een cruciaal onderdeel van deze beschermende laag is een molecuul genaamd lipopolysacharide (LPS). Bacteriën hebben een bepaalde hoeveelheid LPS nodig; te veel of te weinig doodt de cel. Eerder onderzoek uit het laboratorium van Wei Mi, assistent-professor farmacologie aan de Yale School of Medicine, onthulde hoe moleculaire sensoren in E. coli de juiste balans vinden in de LPS-productie.
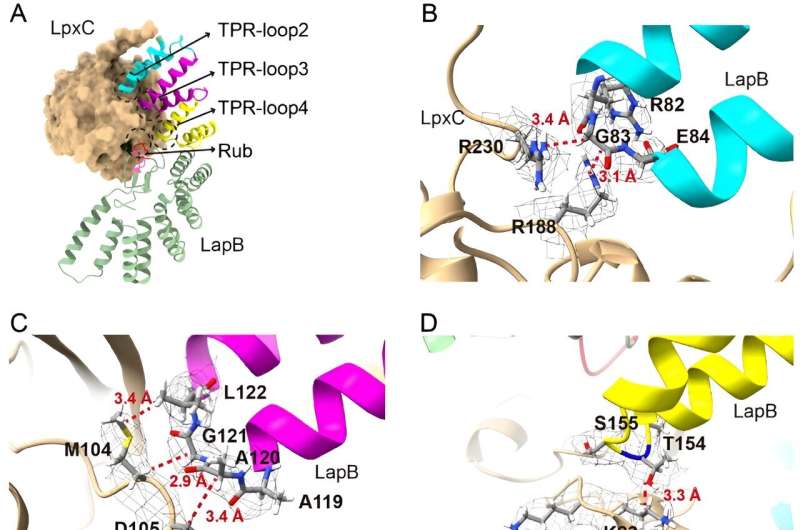
In de nieuwe studie gingen onderzoekers dieper in op het deel van dit proces dat overmatige opbouw van LPS voorkomt, met als doel te verduidelijken hoe een eiwit genaamd LapB zich bindt aan en de afbraak stimuleert van LpxC, een enzym dat de LPS-productie op gang brengt. De onderzoekers gebruikten cryogene elektronenmicroscopie om de structuur van het complex te bekijken dat ontstaat wanneer deze twee moleculen binden.
"Kijken naar de structuur biedt de meest directe visualisatie van hoe dit deel van het proces plaatsvindt", zegt Mi, senior auteur van de nieuwe studie. "Toen we de structuur eenmaal zagen, hebben we veranderingen aan de moleculen aangebracht om te zien hoe dat de binding beïnvloedde, waardoor we konden identificeren welke componenten nodig zijn voor LapB om LpxC te herkennen."
Maar de onderzoekers ontdekten tot hun verbazing ook dat LapB een tweede rol speelde. Het is niet alleen verantwoordelijk voor de afbraak van LpxC, maar remt ook de werking van het enzym voordat er afbraak plaatsvindt.
"In principe sluit LapB LpxC af voordat het het weggooit", zegt Mi. "We begrijpen niet waarom bacteriën dit doen, omdat het overbodig lijkt, maar dit is waar we nu naar kijken."
De onderzoekers speculeren dat deze dubbele rol mogelijk te maken heeft met flexibiliteit. Afbraak is een langzaam maar onomkeerbaar proces, terwijl remming snel en omkeerbaar is. Als bacteriën over beide capaciteiten beschikken, kunnen ze sneller reageren op veranderingen in het milieu.
"Dit is allemaal relevant voor de ontwikkeling van antibiotica", zei Mi. "Deze details zullen ons helpen nieuwe benaderingen te vinden en te begrijpen waarom andere niet werken."