
Wetenschap
Vloeistofdruppeltjes bepalen hoe cellen reageren op verandering, blijkt uit onderzoek
Gezonde cellen reageren op de juiste manier op veranderingen in hun omgeving. Ze doen dit door te voelen wat er buiten gebeurt en een commando door te geven aan het precieze biomolecuul in het precieze domein dat de noodzakelijke reactie kan uitvoeren.
Wanneer de boodschap op het juiste moment in het juiste domein terechtkomt, blijft uw lichaam gezond. Als het op het verkeerde moment op de verkeerde plaats terechtkomt, kun je ziektes krijgen zoals diabetes of kanker.
De routes die berichten binnen een cel volgen, worden signaalroutes genoemd. Cellen gebruiken slechts een paar signaalroutes om gelijktijdig op honderden externe signalen te reageren, dus die routes moeten strak worden gereguleerd. Nieuw onderzoek door wetenschappers van de Universiteit van Californië in San Diego heeft een verrassende manier blootgelegd waarop cellen signaalroutes reguleren.
Ze ontdekten dat wanneer er te veel berichten in een cel rondzweven, de boodschappers vloeibare druppeltjes vormen en zichzelf opsluiten op een plek waar ze geen kwaad kunnen doen. Het werk is onlangs gepubliceerd in Molecular Cell .
"Vloeibare druppeltjes organiseren cellulaire biochemische activiteiten volgens spatiotemporele regulatie", zegt Jin Zhang, Ph.D., hoogleraar farmacologie aan de UC San Diego School of Medicine en senior auteur van het onderzoek.
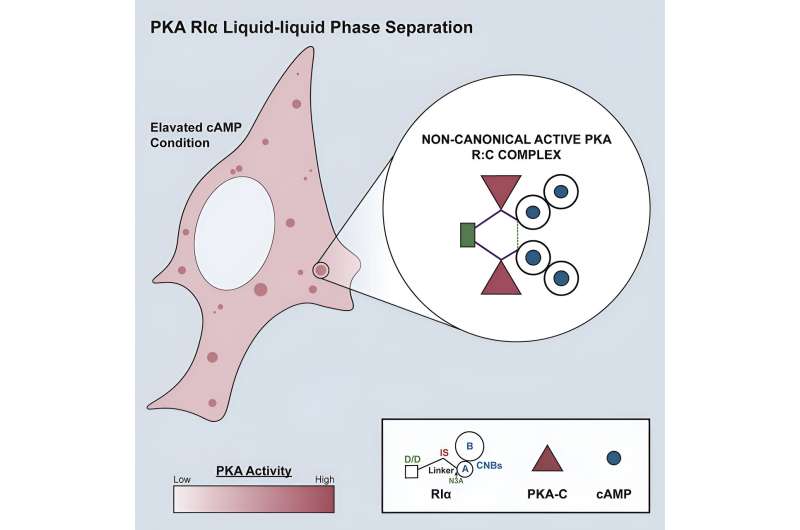
De wetenschappers werkten met een van de belangrijkste routes voor cellulaire communicatie. Het wordt de cAMP/PKA-signaleringsroute genoemd vanwege de twee belangrijkste actoren:cAMP (cyclisch adenosinemonofosfaat) en PKA (cAMP-afhankelijke proteïnekinase). Wanneer cAMP een signaal van het celoppervlak ontvangt, activeert het PKA. PKA stuurt de boodschap door naar het juiste domein, of het nu gaat om het vertellen van een specifiek gen om meer eiwitten te produceren of het stimuleren van een enzym om een gezond glucosegehalte in het bloed te handhaven.
Maar zo eenvoudig is het niet. PKA verzendt berichten naar honderden verschillende domeinen. Volgens Zhang:“Het ene moment moet PKA actief zijn op het plasmamembraan. Maar het volgende moment moet het van het plasmamembraan loskomen en actief zijn op het mitochondriale membraan. Tien minuten later moet het echt in het plasmamembraan zitten. de kern om transcriptie in te schakelen."
Om de zaken nog ingewikkelder te maken, zetten cellen soms te veel cAMP en PKA aan. Wanneer dat gebeurt, wordt de celsignalering hyperactief en willekeurig. Zhang legt uit:"Verschillende microdomeinen besturen verschillende dingen. Laten we zeggen dat je wilt dat het cAMP-niveau hoog is rond calciumkanalen, maar laag op 10 nanometer afstand. Hoe bereikt de cel dat? Door cAMP te controleren."
Maar ze vervolgt:"PKA is hetzelfde. Meestal wordt het naar specifieke domeinen gerekruteerd door eiwitten te verankeren. Maar als de PKA-activiteit te hoog is, activeert het domeinen die het niet zou moeten activeren. Dat is verlies aan specificiteit." /P>
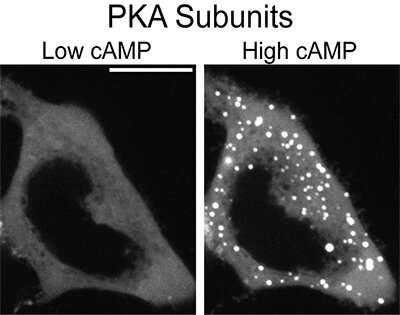
Dat is de reden waarom cellen volgens het nieuwe onderzoek vloeibare druppeltjes vormen om ervoor te zorgen dat de juiste boodschap op het juiste moment in het juiste domein terechtkomt. Toen de wetenschappers de samenstelling van de vloeistofdruppeltjes analyseerden, evenals het tijdstip waarop ze werden gevormd, ontdekten ze dat cellen de druppels vormden met behulp van een subeenheid van PKA wanneer te veel cAMP en PKA werden aangezet. Op die manier sekwestreerden de druppels de overtollige cAMP en PKA en onderdrukten niet-specifieke signalen.
In eerder werk ontdekten de auteurs dat een zeldzame vorm van leverkanker, fibrolamellair carcinoom (FLC) genoemd, de vorming van deze vloeistofdruppeltjes blokkeert, wat resulteert in ongecontroleerde celsignalering. "Wij denken dat het verdwijnen van de vloeistofdruppeltjes een belangrijke bijdrage levert aan deze hyperactieve signalering die tot tumorigenese leidt", zegt Zhang.
FLC is een zeldzame maar verwoestende ziekte. Het treft meestal mensen jonger dan 40 jaar met gezonde levers. De auteurs van dit artikel hopen te onderzoeken of andere vormen van kanker ook verlies van vloeistofdruppels veroorzaken en wat de moleculaire mechanismen erachter zijn. Hun uiteindelijke doel is het ontwerpen van een moleculair therapeutisch middel om FLC te behandelen – “alles”, zegt Zhang, “dat ons helpt tegemoet te komen aan de onvervulde behoeften van FLC-patiënten.”
De auteurs van deze studie zijn onder meer Julia C. Hardy, Emily H. Pool, Jessica G.H. Bruystens, Xin Zhou, Qingrong Li, Daojia R. Zhou, Max Palay, Gerald Tan, Lisa Chen, Jaclyn LC Choi, Ha Neul Lee Dong Wang, Susan S. Taylor, Sohum Mehta, Jin Zhang aan de Universiteit van Californië in San Diego en Stefan Strack aan de Universiteit van Iowa.