
Wetenschap
Nieuwe mechanismen voor splitsingsonafhankelijke activering van gasderminen onthuld
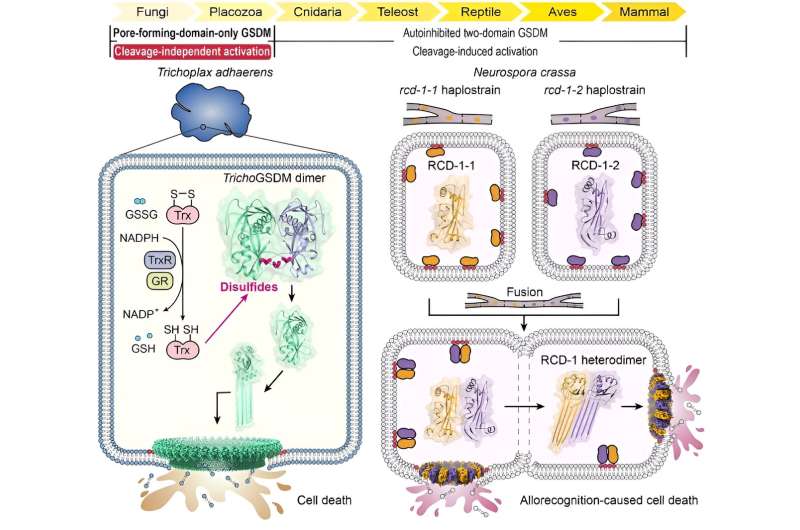
Pyroptose is een vorm van geprogrammeerde celdood die wordt gemedieerd door de gasdermin-eiwitfamilie (GSDM), die een belangrijke rol speelt bij de verdediging van het lichaam tegen infectie met pathogenen, de eliminatie van abnormale of schadelijke cellen en andere processen. GSDM's zijn een evolutionair geconserveerde klasse van porievormende eiwitten die wijd verspreid zijn onder verschillende bacteriën, schimmels, ongewervelde dieren en alle gewervelde dieren.
GSDM's hebben doorgaans een auto-geremde structuur met twee domeinen. Proteolytische splitsing lijkt een universeel mechanisme te zijn voor de activering van alle GSDM's. Of er andere activeringsmechanismen zijn dan proteasesplitsing voor GSDM's is onbekend.
In een studie gepubliceerd in Science hebben onderzoekers onder leiding van prof. Ding Jingjin van het Instituut voor Biofysica van de Chinese Academie van Wetenschappen en prof. Shao Feng van het Nationaal Instituut voor Biologische Wetenschappen nieuwe mechanismen onthuld voor splitsingsonafhankelijke activering van twee soorten GSDM-eiwitten uit lagere eukaryoten.
Door middel van uitgebreide sequentiehomologieanalyse identificeerden de onderzoekers eerst een GSDM-eiwit in de basale metazoan Trichoplax adhaerens (TrichoGSDM) dat alleen een porievormend domein bevat. Karakterisering van gezuiverd TrichoGSDM onthulde dat dit GSDM-eiwit in twee toestanden voorkomt:monomeer en homodimeer, waarbij alleen het monomere eiwit het vermogen heeft om poriën op liposomen te vormen.
Structurele en biochemische analyses onthulden dat het disulfide-gebonden homodimeer de auto-remmende toestand van TrichoGSDM vertegenwoordigt, die wordt geactiveerd tot de monomere toestand door disulfidebindingen te verminderen, verder te oligomeriseren en poriën op het celmembraan te vormen om pyroptose-achtige celdood te induceren. Dit nieuwe activeringsmechanisme, ontdekt in TrichoGSDM, is het eerste in zijn soort in de hele GSDM-familie.
Daarnaast concentreerden de onderzoekers zich op een ander type GSDM-eiwit dat alleen het porievormende domein vormt, genaamd RCD-1, dat onlangs werd geïdentificeerd in de filamenteuze schimmel Neurospora crassa. RCD-1 bevat twee homologe eiwitten, RCD-1-1 en RCD-1-2 in verschillende stammen, die de door allorecognitie geïnduceerde schimmelceldood beheersen.
Ze ontdekten dat membraangebonden RCD-1-eiwitten in een inactieve rusttoestand bestaan als ze met rust worden gelaten. Wanneer verschillende stammen echter celfusie ondergaan, komen de twee RCD-1-eiwitten elkaar tegen en assembleren zich tot een heterodimeer door specifieke intermoleculaire herkenning, waardoor verder heterooligomere poriën op het celmembraan worden gevormd om pyroptose-achtige celdood uit te voeren.
In deze studie vertegenwoordigen TrichoGSDM en RCD-1 twee soorten porievormende GSDM's die alleen domeinen vormen, afgeleid van eenvoudige en oude eukaryoten die verschillende splitsingsonafhankelijke activeringsmechanismen gebruiken.
TrichoGSDM is een disulfide-gekoppeld auto-geremd dimeer en wordt geactiveerd door de reductie van de disulfiden, wat duidt op een redox-responsieve functie. De porievormende activiteit in RCD-1 wordt gestimuleerd door heteroherkenning tussen RCD-1-1 en RCD-1-2 van genetisch onvergelijkbare schimmelstammen, die ten grondslag liggen aan door allorecognitie geïnduceerde celdood in N. crassa.
De diverse activeringsmechanismen suggereren dat GSDM-eiwitten kunnen reageren op een breed scala aan fysiologische signalen en kunnen deelnemen aan meerdere biologische processen. Bovendien hebben deze porievormende GSDM-eiwitten die alleen het domein vormen het potentieel om te worden ontwikkeld als nieuwe hulpmiddelen om celdood te induceren, onafhankelijk van proteasesplitsing, waardoor pyroptose-gerelateerd fundamenteel en translationeel onderzoek wordt vergemakkelijkt.