
Wetenschap
Wetenschappers onthullen hoe SID-1 dsRNA herkent en systemische RNA-interferentie initieert
RNA-interferentie (RNAi) is een fascinerend biologisch proces in wormen, planten, schimmels en metazoën dat een waardevol hulpmiddel is geweest voor het bestuderen van de genfunctie en als therapie.
Bij Caenorhabditis elegans speelt het multipass transmembraaneiwit, systemisch RNA interferentie defectief eiwit 1 (SID-1), een onmisbare rol bij de opname en afgifte van dubbelstrengig RNA (dsRNA) tussen cellen en weefsels, wat leidt tot systemisch RNAi. P>
Bovendien zijn twee menselijke SID-1-homologen, SID1-transmembraanfamilielid 1 (SIDT1) en SIDT2, betrokken bij RNA-transport. De onderliggende moleculaire mechanismen van hoe SID-1 dsRNA specifiek onderscheidt van enkelstrengs RNA (ssRNA) en DNA en het daaropvolgende dsRNA-transport tussen cellen mogelijk maken, blijven echter onbekend.
Antwoorden op deze vragen zijn belangrijk voor het begrijpen van systemische RNAi en voor hulp bij RNA-gerelateerde toepassingen.
Dr. Zhang Jiangtao in de groep van prof. Jiang Daohua van het Institute of Physics van de Chinese Academie van Wetenschappen heeft aangetoond hoe SID-1 specifiek dsRNA herkent en belangrijke inzichten heeft verschaft in de internalisatie van dsRNA door SID-1 door cryo-EM te combineren, in vitro- en in vivo-experimenten. Het werk is gepubliceerd in het tijdschrift Nature Structural &Molecular Biology .
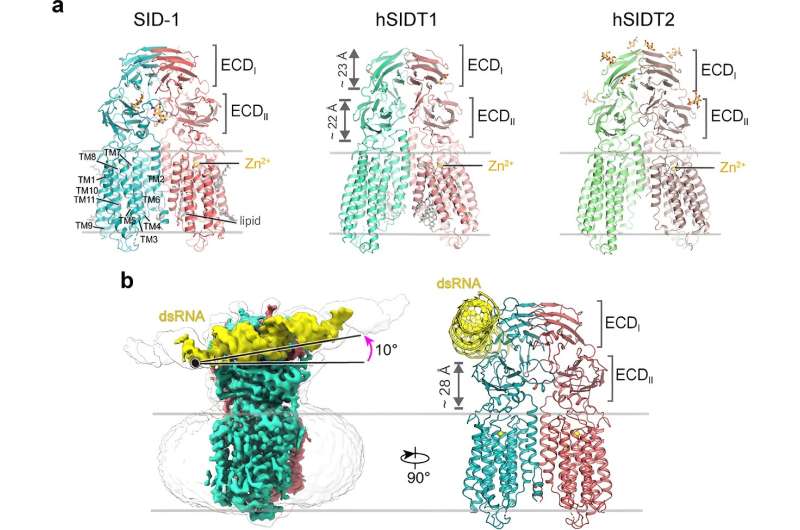
Meer dan twintig jaar lang werd gedacht dat SID-1 functioneerde als een dsRNA-kanaal. Hier hebben de onderzoekers cryo-EM-structuren met hoge resolutie van SID-1 en de menselijke SID-1-homologen SIDT1 en SIDT2 opgelost, waardoor de geconserveerde architectuur van C. elegans en menselijke SID-1-homologen werd onthuld.
De SID-1-homologen zijn homodimeer georganiseerd. Verrassend genoeg vertoont het SID-1-dimeer geen duidelijke porie binnen het transmembraandomein, wat suggereert dat SID-1 mogelijk niet als een dsRNA-kanaal functioneert. MST-bindingstesten bevestigden dat SID-1 krachtig en specifiek kan binden aan dsRNA, maar niet aan dsDNA.
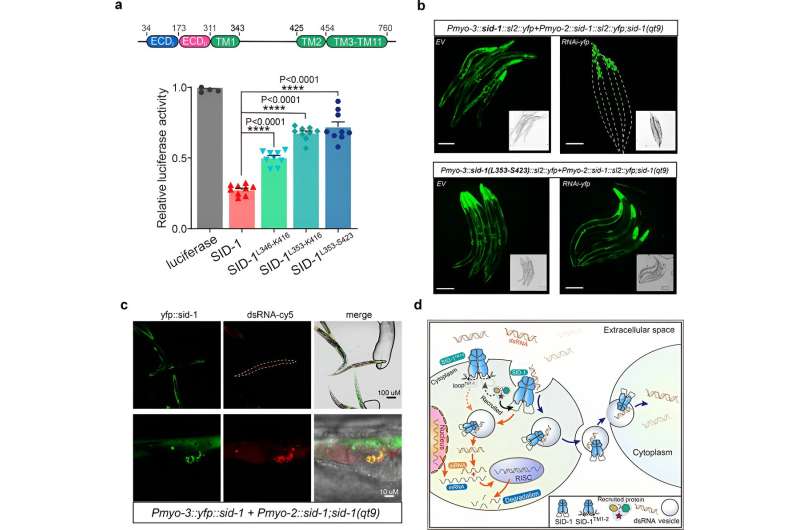
Vervolgens verkregen de onderzoekers de cryo-EM-structuur van het SID-1-dsRNA-complex, waarmee de gedetailleerde dsRNA-bindingsmodus en de moleculaire determinanten werden aangetoond van hoe SID-1 dsRNA onderscheidt van ssRNA en DNA.
Interessant genoeg zijn dergelijke determinanten niet aanwezig in menselijk SIDT1 of SIDT2. De structurele bevindingen werden ondersteund door mutagenesestudies met behulp van MST-bindingstesten, dsRNA-opname in S2-cellen en in vivo systemische RNAi-testen.
Ten slotte laten de onderzoekers zien dat de verwijdering van de lange intracellulaire lus-transmembraanhelices 1 en 2 geen invloed had op de dimerisatie van SID-1, cellokalisatie of dsRNA-binding, maar dat het de opname van dsRNA in S2-cellen en systemische RNAi in C. elegans aanzienlijk verminderde.
Bovendien onthulde co-lokalisatie dat SID-1 en dsRNA zich op dezelfde locatie bevinden in blaasjesachtige subcellulaire organellen. Op basis van deze resultaten stellen de onderzoekers voor dat SID-1 functioneert als een dsRNA-receptor en de daaropvolgende dsRNA-internalisatie vergemakkelijkt door endocytair-gerelateerde eiwitten te recruteren via de lange lus.