
Wetenschap
Als fossielen tot leven komen:SARS-CoV-2 spike, syncytin-1 en andere merkwaardige fusie-eiwitten
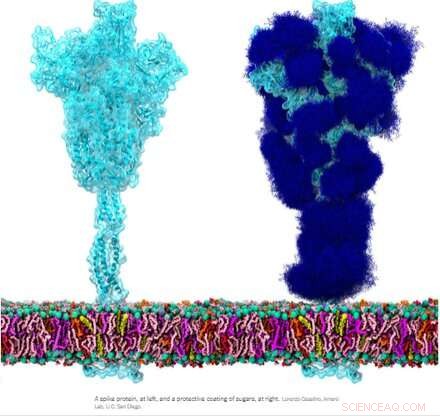
Krediet:Wikipedia
Het homotrimere spike-glycoproteïne (S) van SARS-CoV-2, met name de S2-subeenheid, is een buitengewoon fusie-eiwit. Het kan virale deeltjes aan cellen fuseren en ook cellen aan cellen fuseren om veelsoortige syncytia tussen verschillende celfenotypes te creëren. Afhankelijk van de exacte versies die worden overwogen, kan de piek deze prestaties leveren via meerdere mechanismen die zowel aan de intracellulaire als aan de extracellulaire zijde van celmembranen werken.
Deze fusiefuncties zijn enigszins analoog aan typische homotrimere ENV (envelop) eiwitten zoals ons syncytine-1 endogene retrovirale ENV-eiwit en het GP160 ENV-glycoproteïne van het HIV-virus. GP160, het 'spike'-eiwit van HIV, wordt uiteindelijk op zijn eigen furine-splitsingsplaats (ook gevonden in syncytine-1) verwerkt tot een GP120- en een GP41-eiwit, die beide verschillende pre- en post-fusieconfiguraties kunnen aannemen. Het SARS-CoV-2-genoom specificeert echter al een afzonderlijk klein ENV-eiwit (gemakkelijk aangeduid als E), dat samenkomt in een vermoedelijk kationkanaal met een centrale fusieporie.
Er zijn geen env-, pol-, gag- of pro-genen als zodanig gedefinieerd voor het SARS-CoV-2-genoom, zoals het geval is voor de retrovirussen, die als onderdeel van hun levenscyclus in ons DNA moeten integreren. Vreemd genoeg hebben onderzoekers ontdekt dat het SARS-CoV-2-spike-eiwit, dat zich uit zichzelf gedraagt, direct deelneemt aan de activering van endogene retrovirussen in onze cellen, wat bijdraagt aan de waargenomen pathologie. Wat is hier precies aan de hand?
In het licht van enkele van deze overeenkomsten is gesuggereerd dat antilichamen die tegen het spike-eiwit zijn gegenereerd, mogelijk een kruisreactie zouden kunnen veroorzaken in elk weefsel dat endogene retrovirale eiwitten tot expressie zou kunnen brengen. In het bijzonder tijdens de zwangerschap, waarna placentale trofoblasten zeer bruikbare ENV-eiwitten van veel van dergelijke HERV's tot expressie brengen, waaronder ERVW1 (syncytin-1), ERVFRD-1 (syncytin-2), ERVV-1, ERVV-2, ERVH48-1, ERVMER34-1 , ERV3-1 en ERVK13-1. Syncytine-2-expressie in villeuze cytotrofoblasten is echter sterk gecorreleerd met de mate van ernst van sommige placenta-pathologie zoals pre-eclampsie.
Gelukkig ontdekten onderzoekers dat er vrijwel geen directe sequentiehomologie is tussen spike en syncytin-1, en dat er weinig kans is op kruisreactiviteit. Schrijven in het tijdschrift Animal Cells and Systems , hebben Koreaanse onderzoekers een groot aantal monoklonale antilichamen getest en konden ze concluderen dat hoewel oude genomische relikwieën zoals HERV's door SARS-CoV-2 in verschillende weefsels kunnen worden geactiveerd, er geen risico is op kruisreactiviteit of zelfs onvruchtbaarheid.
Maar als spike-eiwit nog steeds heel goed in staat is om ongewenste celfusie te veroorzaken, hoe kunnen we deze schijnbaar willekeurige activiteit dan beter definiëren, en bovendien, wat kunnen we eraan doen? Misschien is de eerste stap om wat geavanceerder te worden met de terminologie van celfusie. Schrijven in het tijdschrift Oncotarget , biedt auteur Yuri Lazebnik wat stof tot nadenken. Een syncytium dat wordt geproduceerd uit cellen van hetzelfde type, bijvoorbeeld bij de fusie van twee of meer pneumocyten, wordt een homokaryon genoemd. Een heterokaryon zou dan een syncytium zijn dat is gemaakt van bijvoorbeeld een pneumocyt die is gefuseerd met een epitheliale voorloper, of misschien een leukocyt. In het algemeen geldt dat als cellen eenmaal combineren, alle weddenschappen zijn uitgeschakeld - of ze later zichzelf en hun kernen kunnen sorteren om replicatiecompetente mononucleaire nakomelingen te genereren, is nog steeds onvolledig bekend.
De vorming van door spikes geïnduceerde syncytia in de longen van COVID-10-patiënten is in vele vormen gevonden, elk met hun eigen opkomende eigenschappen die kunnen bijdragen aan de gevolgen van de ziekte. Er is bijvoorbeeld gevonden dat trilhaarcellen in de luchtwegen, alveolaire type 2 pneumocyten en epitheliale voorlopers deelnemen aan de vaak waargenomen meerkernige 'reuzencellen'. Gooi er een paar leukocyten met spikes in en dingen worden snel moeilijk te voorspellen. Misschien is een nog alarmerende situatie de vorming van een syncytium in de cellen die onze bloedvaten bekleden, wat zou kunnen bijdragen aan trombose. De daaropvolgende dood en uiteindelijke vervelling van een stukje ongepast gefuseerde cellen zou een aanzienlijk gebied van trombogene basaalmembraan bloot kunnen leggen. Een vezel van 20 micron collageen, het hoofdbestanddeel van het basaalmembraan, is voldoende om bloedplaatjesafhankelijke stolling te veroorzaken.
Maar genoeg van deze angstzaaierij. Onderzoekers hebben een reeks reeds goedgekeurde geneesmiddelen geïdentificeerd die door spikes geïnduceerde celfusie voorkomen en TMEM16F remmen, een essentieel eiwit voor de vorming van syncytium. TMEM16F heeft de dubbele rol van een door calcium geactiveerd ionenkanaal dat de chloride-uitscheiding reguleert, evenals een lipide-scramblase die fosfatidylserine (PS) naar het celoppervlak verplaatst. Deze PS-externalisatie is vereist voor celfusie in veel systemen, waaronder door spikes geïnduceerde syncytia. Overigens regelen scramblas ook de snelheidsbeperkende stappen van de bloedstollingscascade en kunnen ze het mechanisme zijn achter door pieken geïnduceerde trombose.
De bloedstollingsroutes zijn een heel apart complex van wormen, maar het volstaat hier te zeggen dat de primaire trigger van stolling veroorzaakt door virale infecties de zogenaamde extrinsieke 'tenase' is. Tenasen zijn enzymen die Factor X of FX (vandaar tien-ase) verwerken in de activeringsroute van de weefselfactor (TF), die in wezen fungeren als de lont voor het genereren van trombus. De resulterende complexen worden geassembleerd op geëxternaliseerd PS in aanwezigheid van calciumionen. TF is in zekere zin versleuteld en is dus niet in staat om de downstream-doelfactor FVIIa te activeren totdat deze is gedecodeerd door externe PS.
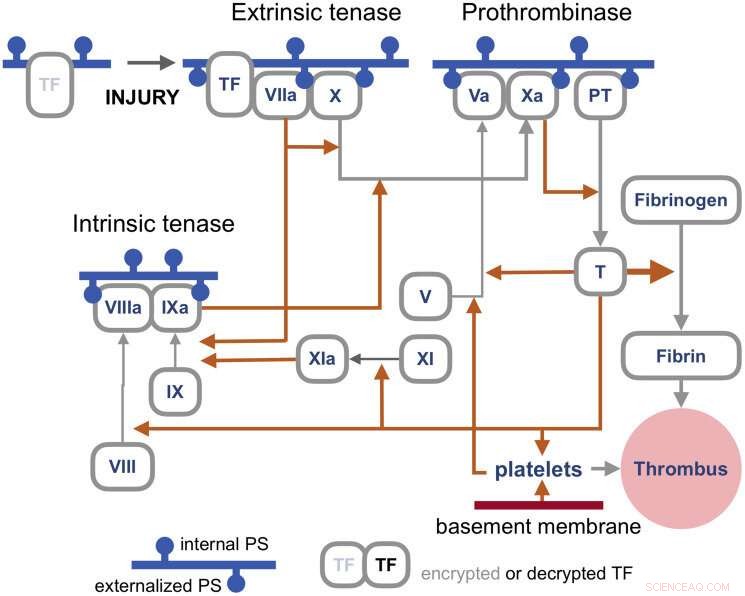
Coagulatie routes. Krediet:Y. Lazebnik 2021
Het besef dat sommige fusogene virale of zelfs retrovirale eiwitten, die toevallig tot expressie worden gebracht in bepaalde delen van het lichaam, waarschijnlijk kunnen bijdragen aan trombotische gebeurtenissen, is van enorm praktisch belang. Men hoeft niet verder te zoeken dan de ruime voorgestelde pijplijn van Moderna voor therapeutische mRNA-geleverde voorzieningen op basis van deze eiwitten voor allerlei soorten virale beledigingen om even te pauzeren voor inspectie. Er is zeker geen gebrek aan methoden die momenteel worden gebruikt voor het bouwen van antigene spike-eiwitten voor vaccinaties. Afhankelijk van hoeveel van de spike-code wordt gebruikt, welke splitsingssequenties worden opgenomen en welke delen worden gestabiliseerd, kunnen zeer verschillende eiwitten worden gemaakt. Het is waarschijnlijk eerlijk om te zeggen dat pieken over de volledige lengte in grote twijfelachtige vectoren of geïnactiveerde virale deeltjes grotendeels zijn vervaagd ten gunste van kleinere maar meer immunogene brouwsels.
Longen en bloedvaten zijn zeker kritieke aandachtspunten bij elke SARS-CoV-2-infectie, maar wat kunnen onze kostbare neuronen - kunnen ze ook samensmelten? Het is duidelijk dat het neuronen kan samensmelten in hersenorganoïden, maar nogmaals, wat kunnen onderzoekers niet doen met deze wonderen van onmiddellijke onderzoekspublicatie. Als we breder kijken naar andere soorten virussen, lijkt de fusie van neuronen, gliacellen en zelfs axonen de standaard te zijn bij het veroorzaken van een groot aantal mogelijke neurologische problemen. Het pseudorabiësvirus overbrugt bijvoorbeeld synapsen om de activiteit van neuronen elektrisch te koppelen door hun axonen te fuseren. Fusies met glia zijn op dezelfde manier gedetecteerd en in verband gebracht met aanhoudende neuropathische pijn na de acute fase van herpes zoster (gordelroos). Vanaf deze woensdag zijn we ons er allemaal van bewust dat SARS-CoV-2 het eiwit vimentine kan gebruiken als een manier om endotheelcellen te infecteren. Het mag niemand ontgaan, of in ieder geval de neurowetenschappers, dat vimentine de belangrijkste marker is die wordt gebruikt voor het identificeren van gliacellen.
Bovendien suggereert het snel groeiende oeuvre waarin wordt gekeken naar endogene retrovirus-reactivering bij neurodegeneratieve ziekten de rationele geest verder dat celfusie ook betrokken kan zijn bij dit soort pathologie.
 Papoea-Nieuw-Guinea zet leger in om vulkaanuitbarsting te helpen
Papoea-Nieuw-Guinea zet leger in om vulkaanuitbarsting te helpen Gevaarlijke klimaatverandering is waarschijnlijk, concludeert nieuw onderzoek
Gevaarlijke klimaatverandering is waarschijnlijk, concludeert nieuw onderzoek Is CO2 slecht voor de planeet?
Is CO2 slecht voor de planeet?  Arctische permafrost bevat mogelijk slapende reus van de koolstofemissies ter wereld
Arctische permafrost bevat mogelijk slapende reus van de koolstofemissies ter wereld Hoe passen planten en dieren zich aan de woestijn aan?
Hoe passen planten en dieren zich aan de woestijn aan?
Hoofdlijnen
- Hebben menselijke embryo's en kanker dezelfde startlont?
- De mysterieuze Denisovans
- Onderzoekswetenschappers ontdekken nieuwe productieroute voor SOS-signalen van planten
- Twee soorten fagocyten
- Ontdekking van de Mitochondria
- Sommige mariene soorten zijn kwetsbaarder voor klimaatverandering dan andere
- Gouden aardappel levert een overvloed aan vitamine A en E
- Projectideeën om het menselijke spijsverteringsstelsel te laten zien op de middelbare school voor studenten
- Een mogelijke verklaring voor hoe kiemlijnen worden verjongd
- CRISPR-dragende nanodeeltjes bewerken het genoom
- Maken regenachtige dagen je echt down?

- Ribosomen: definitie, functie en structuur (eukaryoten en prokaryoten)
- Octopussen geven de voorkeur aan bepaalde wapens bij het jagen en passen tactieken aan hun prooi aan

- Onderzoeker bestudeert vogels die alle paringsregels overtreden

 Nu zie je het, nu doe je dat niet:Verborgen kleuren bij toeval ontdekt
Nu zie je het, nu doe je dat niet:Verborgen kleuren bij toeval ontdekt Wolkenspotters helpen golfachtige formatie om officiële erkenning te verkrijgen
Wolkenspotters helpen golfachtige formatie om officiële erkenning te verkrijgen Sigarettenpeuken belemmeren plantengroei - studie
Sigarettenpeuken belemmeren plantengroei - studie Extreme droogte in Brazilië veroorzaakt dodelijke zandstormen
Extreme droogte in Brazilië veroorzaakt dodelijke zandstormen Stabiliserende liganden maken nanoclusters helderder
Stabiliserende liganden maken nanoclusters helderder Houding ten opzichte van ras, immigratie onderstreepte het wisselen van stemmen bij de verkiezingen van 2016
Houding ten opzichte van ras, immigratie onderstreepte het wisselen van stemmen bij de verkiezingen van 2016 Biologisch risicopotentieel van onderzochte nanodeeltjes
Biologisch risicopotentieel van onderzochte nanodeeltjes LIGO detecteert voor de derde keer zwaartekrachtsgolven
LIGO detecteert voor de derde keer zwaartekrachtsgolven
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

