
Wetenschap
De hersencellen die ons vertragen als we ziek waren
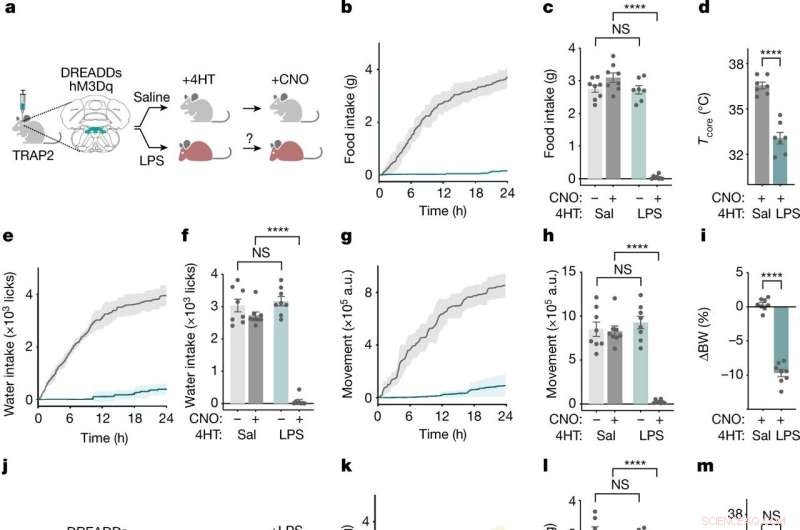
NTS-AP-neuronen reguleren ziektegedrag. een , Methode voor TRAP2-labeling en reactivering van NTS-AP-neuronen met behulp van activerende hM3Dq (Gq) DREADD's. Grijze muis, normaal; rode muis, ziek. b ,e ,g , Cumulatieve voedselinname (b ), wateropname (e ) en beweging (g ) gedurende 24 h na reactivering van met zoutoplossing gelabelde (grijs) en LPS-gelabelde (cyaan) neuronen. c ,v ,u , Voedselinname (c ) (ANOVA P < 1 × 10 −7 ), wateropname (f ) (ANOVA P < 1 × 10 −7 ) en beweging (u ) (ANOVA P < 1 × 10 −7 ) 12 uur na CNO-injectie voor reactivering van met zoutoplossing gelabelde (donkergrijs) en LPS-gelabelde (donkercyaan) neuronen; zoutoplossingcontroles voor CNO-toediening worden ook getoond (lichtgrijs; lichtcyaan). d ,ik , Verandering in kerntemperatuur (ongepaarde t -test P = 4.6 × 10 −6 ) 4 uur na heractivering (d ) en percentage lichaamsgewicht (ongepaarde t -test P < 1 × 10 −7 ) 24 uur na heractivering (i ) van met zoutoplossing gelabelde (grijs) en LPS-gelabelde (cyaan) neuronen. In alle panelen, dieren met zoutoplossing, n = 8; LPS-gelabelde dieren, n = 7. j , Schema van TRAP2-labeling en inactivatie met behulp van remmende hM4Di (Gi) DREADD's tijdens gelijktijdige LPS-blootstelling. k ,n ,p , Cumulatieve voedselinname (k ), wateropname (n ) en beweging (p ) gedurende 24 h na op CNO gebaseerde remming en gelijktijdige LPS-behandeling (0,5 mg kg −1 , i.p.) van met zoutoplossing gelabelde (grijs) en LPS-gelabelde (donkergele) neuronen. Zoutbehandeling van LPS-gelabelde neuronen (lichtgeel) getoond ter referentie. ik ,o ,q , Voedselinname (l ) (ANOVA P = 2.9 × 10 −7 ), wateropname (o ) (ANOVA P = 2.1 × 10 −7 ) en beweging (g ) (ANOVA P = 3.3 × 10 −4 ) 12 h na remming en gelijktijdige LPS-behandeling (0,5 mg kg −1 , i.p.) van met zoutoplossing gelabelde (donkergrijs) en LPS-gelabelde (donkergeel) neuronen; zoutoplossingcontroles voor CNO-toediening worden ook getoond (lichtgrijs; lichtgeel). m ,r , Verandering in kerntemperatuur (ongepaarde t -test, NS) 4 h na (m ) en percentage lichaamsgewicht (ongepaarde t -test, P = 3.2 × 10 −5 ) 24 uur na (r ) remming en gelijktijdige LPS-behandeling van met zoutoplossing gelabelde (grijs) en LPS-gelabelde (gele) neuronen. In alle panelen, dieren met zoutoplossing, n = 7; LPS-gelabelde dieren, n = 7.***P <0.001, ****P <0,0001 en NS, niet significant (P> 0,05). Alle foutbalken vertegenwoordigen s.e.m. Krediet:Natuur (2022). DOI:10.1038/s41586-022-05161-7
We hebben de neiging om minder te eten, drinken en bewegen als we ons slecht voelen. En we zijn niet de enige:de meeste dieren verminderen diezelfde drie gedragingen wanneer ze een infectie bestrijden.
Nu lokaliseert een nieuwe studie het cluster van neuronen die deze reacties beheersen, ook wel ziektegedrag genoemd. Door immuunreacties bij muizen uit te lokken, toonden onderzoekers aan dat een specifieke populatie van cellen in de hersenstam krachtig drie veelbetekenende ziektegedragingen induceert. Bovendien verstoort het remmen van deze neuronen elk van deze gedragselementen van de ziektereactie. De bevindingen, gepubliceerd in Nature , koppelt ontstekingen direct aan neurale paden die het gedrag reguleren en biedt inzicht in hoe het immuunsysteem interageert met de hersenen.
"We staan nog in de kinderschoenen om de rol van de hersenen bij infectie te begrijpen", zegt Jeffrey M. Friedman, professor Marilyn M. Simpson aan de Rockefeller University. "Maar met deze resultaten hebben we nu een unieke kans om ons af te vragen:hoe zien je hersenen eruit als je ziek bent?"
Het is aangetoond dat ziektegedrag een belangrijke rol speelt bij het herstel van een dier van een infectie. Eerdere studies hebben die theorie versterkt door aan te tonen dat dieren die gedwongen werden te eten als ze ziek waren, een significant verhoogde mortaliteit vertoonden. "Deze gedragsveranderingen tijdens infectie zijn erg belangrijk om te overleven", zegt hoofdauteur Anoj Ilanges, een voormalig afgestudeerde student in het laboratorium van Friedman, nu groepsleider op de HHMI Janelia Research Campus
Maar het is nooit duidelijk geweest hoe de hersenen die bijna universele drang coördineren om maaltijden te weigeren en onder de dekens te kruipen bij het begin van een infectie. Dus gingen Friedman en Ilanges op zoek naar de hersengebieden achter ziektegedrag bij muizen.
Het team begon met het blootstellen van muizen aan LPS, een stuk bacteriële celwand dat het immuunsysteem activeert en krachtig ziektegedrag induceert. Kort na een injectie met LPS was er een piek in activiteit in een hersenstamgebied dat bekend staat als het dorsale vagale complex, onder een populatie van neuronen die het neuropeptide ADCYAP1 tot expressie brengen. Om te bevestigen dat ze de juiste hersencellen hadden gevonden, activeerden de onderzoekers die neuronen vervolgens in gezonde muizen en ontdekten ze dat de dieren minder aten, dronken en bewogen. Wanneer de ADCYAP1-neuronen daarentegen werden gedeactiveerd, was het effect van LPS op dit gedrag significant verminderd.
"We wisten niet of dezelfde of verschillende neuronen elk van deze gedragingen reguleerden", zegt Friedman. "We vonden het verrassend dat een enkele neuronale populatie elk van deze componenten van de ziekterespons lijkt te reguleren."
De auteurs waren echter niet helemaal verrast dat dit hersenstamgebied betrokken was bij het mediëren van ziektegedrag. Het dorsale vagale complex is een van de weinige fysiologische kruispunten van het centrale zenuwstelsel, waar een afwezigheid van de bloed-hersenbarrière het mogelijk maakt dat circulerende factoren in het bloed informatie rechtstreeks naar de hersenen doorgeven. "Deze regio is een soort waarschuwingscentrum voor de hersenen geworden, dat informatie doorgeeft over aversieve of schadelijke stoffen die, vaker wel dan niet, de voedselinname verminderen", zegt Friedman.
In de komende maanden is het team van Friedman bij Rockefeller van plan deze bevindingen op te nemen in hun algemene doel om de fysiologische signalen en neurale circuits te begrijpen die het voedingsgedrag reguleren. Ze zijn specifiek geïnteresseerd in het begrijpen waarom zelfs muizen die zijn ontworpen om vraatzuchtig te eten, toch zullen stoppen met eten wanneer ze worden blootgesteld aan bacteriële infecties.
Ondertussen is Ilanges van plan te onderzoeken welke rol andere hersenregio's spelen als reactie op infecties, waardoor onze kennis van de rol van de hersenen tijdens dit kritieke proces wordt uitgebreid. "We hebben gekeken naar een deel van de hersenen, maar er zijn veel andere die worden geactiveerd door de immuunrespons", zegt hij. "Dit opent de deur om te vragen wat de hersenen doen, holistisch, tijdens infectie." + Verder verkennen
Neuronen in de hersenstam die ziektesymptomen reguleren gevonden in muismodel
 Stralend licht om waterstof te maken
Stralend licht om waterstof te maken Materiaalchemici tappen lichaamswarmte af om slimme kleding van stroom te voorzien
Materiaalchemici tappen lichaamswarmte af om slimme kleding van stroom te voorzien Kaliumnitraat kopen
Kaliumnitraat kopen Het beoordelen van de risico's van vetwerende chemicaliën in voedselverpakkingen vereist nieuwe methoden, studies
Het beoordelen van de risico's van vetwerende chemicaliën in voedselverpakkingen vereist nieuwe methoden, studies Directe koppeling van arylhalogeniden en alkyllithiumverbindingen door palladiumkatalyse
Directe koppeling van arylhalogeniden en alkyllithiumverbindingen door palladiumkatalyse
 Klimaat in een zoetwaterbioom
Klimaat in een zoetwaterbioom  Kan baking soda het milieu redden?
Kan baking soda het milieu redden?  Onderzoek onthult dat klimaatverandering kwetsbare berghabitats drastisch kan veranderen
Onderzoek onthult dat klimaatverandering kwetsbare berghabitats drastisch kan veranderen Nieuw onderzoek ondersteunt verbeterde vertalingen van weersvoorspellingen voor Spaanstaligen in de VS
Nieuw onderzoek ondersteunt verbeterde vertalingen van weersvoorspellingen voor Spaanstaligen in de VS Warmhoudmuts van 1,5 ° C kan de zeespiegelstijging door smeltend ijs halveren
Warmhoudmuts van 1,5 ° C kan de zeespiegelstijging door smeltend ijs halveren
Hoofdlijnen
- Bestorming van het kasteel:nieuwe ontdekking in de strijd tegen bacteriën
- Entomoloog ontdekt ongewervelde dieren die in meer kleurencombinaties voorkomen dan alle andere
- Maken planten muziek?
- Hoe Brain Mapping werkt
- Biologen identificeren algemene resistentie tegen koraalziekte
- Rapport benadrukt kansen en risico's in verband met synthetische biologie en bio-engineering
- Twee eiwitten behouden de pluripotentie van embryonale stamcellen op verschillende manieren
- Studie laat zien hoe vissen in de schemerzone evolueerden
- Kunnen schimmels de grassen van Texas helpen de klimaatverandering het hoofd te bieden?
- Vleesetende planten inspireren slimme gladde oppervlakken en bionische robots
- 195 manieren om de geschilderde dames van Californië te helpen:nieuwe voedselbronnen bieden hoop voor bedreigde vlinders

- Deze boom is het oudste levende organisme van Europa - een soort van,

- Wereldprimeur gebruikt satellieten en oceaanmodellen om de biodiversiteit op de Antarctische zeebodem te verklaren

- Kunnen we onze organen klonen voor gebruik bij een transplantatie?
 Hoe werken luchtpompen?
Hoe werken luchtpompen?  Veldexperiment gebruikt valse e-mails om gender- en raciale vooroordelen bij startende investeerders te meten
Veldexperiment gebruikt valse e-mails om gender- en raciale vooroordelen bij startende investeerders te meten Dynamische full-field optische coherentietomografie:3D live-beeldvorming van retinale organoïden
Dynamische full-field optische coherentietomografie:3D live-beeldvorming van retinale organoïden Landbouw zorgt voor meer dan 90% van de tropische ontbossing
Landbouw zorgt voor meer dan 90% van de tropische ontbossing SCRIM:een innovatieve methode voor 3D-betonprinten
SCRIM:een innovatieve methode voor 3D-betonprinten Boeing 737 MAX en de kosten van een geaarde vloot
Boeing 737 MAX en de kosten van een geaarde vloot Radicalisering begrijpen en veerkracht opbouwen om polarisatie tegen te gaan
Radicalisering begrijpen en veerkracht opbouwen om polarisatie tegen te gaan Mogelijk betaalt u te veel voor advertenties op Google, Bing
Mogelijk betaalt u te veel voor advertenties op Google, Bing
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

