Wetenschap
3D-verpakking van DNA reguleert celidentiteit
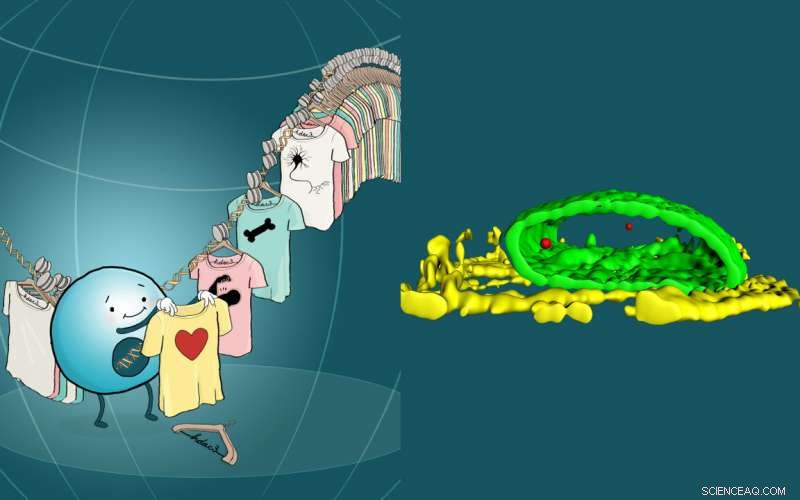
Het bepalen van het lot van de cel vereist de gecoördineerde regulering van genprogramma's die betrokken zijn bij de ontwikkeling en de rijping van weefsels. Het team ontdekte dat Hdac3 de bepaling van het lot van de cel beïnvloedt door zijn rol als een ketting die de driedimensionale organisatie van chromatine in de kern coördineert. De afbeelding (links) vertegenwoordigt het binnenste van de kern waar het lot van individuele cellen wordt bepaald door welke genprogramma's beschikbaar zijn, terwijl andere worden opgeborgen in een ontoegankelijke moleculaire kast. De rechter afbeelding is een 3D-weergave van de locatie van het Titin-gen (rood) in een cardiale myocyt. De nucleaire lamina wordt weergegeven in groen en troponinevezels in geel. Chromatine dat de sleutelgenen bevat die nodig zijn voor het lot van bepaalde cellen, wordt aan de nucleaire periferie gesekwestreerd. Genomische regio's die cardiale genen bevatten, worden vrijgemaakt uit de nucleaire periferie bij differentiatie van stamcellen in cardiale myocyten. Krediet:Kunstwerk door Kate Isenberg kateisenberg.com
De fundamentele mechanismen die bepalen hoe cellen een identiteit vormen, zoals het worden van een spiercel of een zenuwcel, worden niet volledig begrepen. meerdere ziekten, inclusief kanker, zijn gekoppeld aan cellen die tijdens de rijping het verkeerde ontwikkelingspad inslaan. Een nieuwe studie van de Perelman School of Medicine aan de Universiteit van Pennsylvania suggereert dat het vermogen van een stamcel om te differentiëren tot hartspier (en bij uitbreiding andere celtypes) afhangt van welke delen van het genoom beschikbaar zijn voor activering, die wordt gecontroleerd door de locatie van DNA in de celkern.
"De basis van deze studie is het begrijpen van het vermogen van een cel om te reageren op moleculaire signalen om correct het ene of het andere celtype te worden, " zei senior auteur, Rajan Jain, MD, een assistent-professor cardiovasculaire geneeskunde. “We wilden weten hoe dat komt, stap voor stap, omdat stamcellen, in staat om elk celtype in het lichaam te worden, aanleiding geven tot hartspiercellen." Jain en co-senior auteur Jonathan A. Epstein, MD, de uitvoerend vice-decaan en Chief Scientific Officer bij Penn Medicine, publiceerden hun bevindingen deze week in Cel .
De studie suggereert ook dat het weten hoe je kunt controleren hoe snel een cel differentieert naarmate deze rijpt, belangrijke implicaties heeft voor de regeneratieve geneeskunde. ). Deze afgezonderde en tot zwijgen gebrachte gebieden van DNA worden Lamin Associated Domains genoemd, of LAD's. De Cel studie suggereert dat de specifieke regio's van tot zwijgen gebracht DNA aan de periferie helpen bij het definiëren van de identiteit van een cel. Bijvoorbeeld, als zenuwcelgenen stil worden gehouden als LAD's, kunnen ze niet tot expressie worden gebracht, zodat de cel geen neuron wordt. Echter, als hartcelgenen worden vrijgegeven en beschikbaar zijn om tot expressie te worden gebracht, zoals gebeurt tijdens de ontwikkeling van het hart, dan worden die cellen hartspier. Celbiologen weten al jaren dat er wat DNA wordt gevonden in de buurt van het binnenste kernmembraan, maar de functie van deze lokalisatie is onduidelijk. "Ons werk suggereert dat een cel zijn identiteit definieert door in een ontoegankelijke kast de cruciale genen en programma's op te slaan die nodig zijn om te rijpen tot een ander celtype, "Zei Jain. "Met andere woorden, een cel is 'wie' het is omdat het 'wie' het niet is tot zwijgen heeft gebracht." Het Penn-team ontdekte dat een epigenetisch enzym, histondeacetylase (Hdac3) genaamd, DNA aan de nucleaire periferie vastmaakt. "We vroegen:is deze gechoreografeerde controle van DNA-beschikbaarheid ertoe bijdragen dat een cel een bepaald type wordt?" Jain zei. Toen ze Hdac3 in stamcellen verwijderden tijdens differentiatie van hartcellen, ze ongebonden DNA-gebieden die hartspecifieke genen bevatten, waardoor die genen worden geactiveerd, wat leidde tot vroegrijpe, te snelle differentiatie.
"De implicaties van deze studie zijn verstrekkend, "Zei Epstein. "Het vermogen om te bepalen hoe snel een cel differentieert om hartweefsel of andere celtypes te maken, heeft belangrijke implicaties voor regeneratieve geneeskunde." bij veel ziekten, inclusief kanker, cellen brengen genen tot expressie die ze normaal niet zouden doen, waardoor hun identiteit verandert.
De studie behandelt ook een klassiek concept in stamcel- en ontwikkelingsbiologie genaamd "competentie" - het vermogen van een cel om op specifieke manieren op zijn omgeving te reageren. Bijvoorbeeld, sommige longcellen reageren op sigarettenrook om kanker te worden, terwijl anderen dat niet doen. De onderzoekers vermoeden dat dit verschil te wijten kan zijn aan de beschikbaarheid van regio's van het genoom om te reageren op chemicaliën die verband houden met sigarettenrook, of omdat de onbeschikbaarheid van diezelfde genen in niet-reagerende cellen zijn opgesloten in tot zwijgen gebrachte domeinen aan de nucleaire periferie.
jaïna, Epstein, en anderen werken om te bepalen of veranderingen in genoomdomeinen aan de nucleaire periferie, of de moleculaire kettingen die ze daar houden, zijn verantwoordelijk voor de vatbaarheid voor kanker. Deze benadering kan ook worden toegepast op andere ziekten, zoals verschillende vormen van spierdystrofie, hartfalen, en vroegtijdige veroudering als gevolg van erfelijke, genetische afwijkingen van de lamina. "We willen bepalen of deze mutaties leiden tot abnormale binding van DNA en veranderingen in genexpressie en ziekte."
In de toekomst, de onderzoekers zijn van plan om de ruimtelijke organisatie van DNA te manipuleren om cellen over te halen een andere identiteit aan te nemen en vragen welke rol dat kan spelen bij menselijke ziekten die verband houden met een verlies van cellulaire identiteit, inclusief suikerziekte, Ziekte van Alzheimer, vormen van hartfalen, en kanker. De groep breidt ook hun werk uit om patiënten te bestuderen met mutaties in componenten van hun nucleaire lamina.
 aardbeving met een kracht van 5,8 op de schaal van Richter schudt Istanbul door elkaar 8 lichtgewond
aardbeving met een kracht van 5,8 op de schaal van Richter schudt Istanbul door elkaar 8 lichtgewond 20 jaar na dodelijke aardbeving, Istanbul slecht voorbereid op Big One
20 jaar na dodelijke aardbeving, Istanbul slecht voorbereid op Big One Hoe worden klaverzaden gespreid?
Hoe worden klaverzaden gespreid?  Waar gaat onbehandeld afvalwater in ontwikkelingslanden naartoe?
Waar gaat onbehandeld afvalwater in ontwikkelingslanden naartoe? Californië heeft zijn klimaatdoel vroeg bereikt, maar de grootste bron van vervuiling blijft toenemen
Californië heeft zijn klimaatdoel vroeg bereikt, maar de grootste bron van vervuiling blijft toenemen
Hoofdlijnen
- Explosie van ratten, klaverblaadjes, bedmijt, muggen onbedoeld evolutionair gevolg van verstedelijking
- 10, 000 jaar oud DNA bewijst wanneer vissen meren koloniseerden
- Huismuizen kunnen hun vocalisaties moduleren, afhankelijk van het geslacht van de ontvanger
- Wanneer citroenen je leven geven:Herpetofauna-aanpassing aan citrusboomgaarden in Belize
- Het verschil tussen gensequentie en DNA-vingerafdrukken
- Inspanningen zijn bedoeld om de verspreiding van vuurmieren in de VS te beperken
- Haaien spotten drones op patrouille op Australische stranden
- Alles wat je nooit wilde weten over bedwantsen, en meer
- Law of Segregation (Mendel): definitie, toelichting en voorbeelden
 EU legt Google een recordboete van $ 5 miljard op voor mobiele praktijken
EU legt Google een recordboete van $ 5 miljard op voor mobiele praktijken Wetenschappers hebben een revolutionaire manier bedacht om de kilogram te herdefiniëren
Wetenschappers hebben een revolutionaire manier bedacht om de kilogram te herdefiniëren  Meer inzicht in de productie van Higgs-bosonen met behulp van W-bosonen
Meer inzicht in de productie van Higgs-bosonen met behulp van W-bosonen Onderzoeksteam vindt manier om grafeen Dirac-punten te simuleren
Onderzoeksteam vindt manier om grafeen Dirac-punten te simuleren Een betere batterij bouwen, laag voor laag
Een betere batterij bouwen, laag voor laag Autonome viervoeter ontworpen om samen te werken met soldaten
Autonome viervoeter ontworpen om samen te werken met soldaten Zoeken naar discrete tijdkristallen in klassieke veellichamensystemen
Zoeken naar discrete tijdkristallen in klassieke veellichamensystemen Wat is de identiteitseigenschap van vermenigvuldiging?
Wat is de identiteitseigenschap van vermenigvuldiging?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | German | Dutch | Danish | Norway | Swedish |

-
Wetenschap © https://nl.scienceaq.com