Wetenschap
Een moleculaire snaartelefoon aan het werk
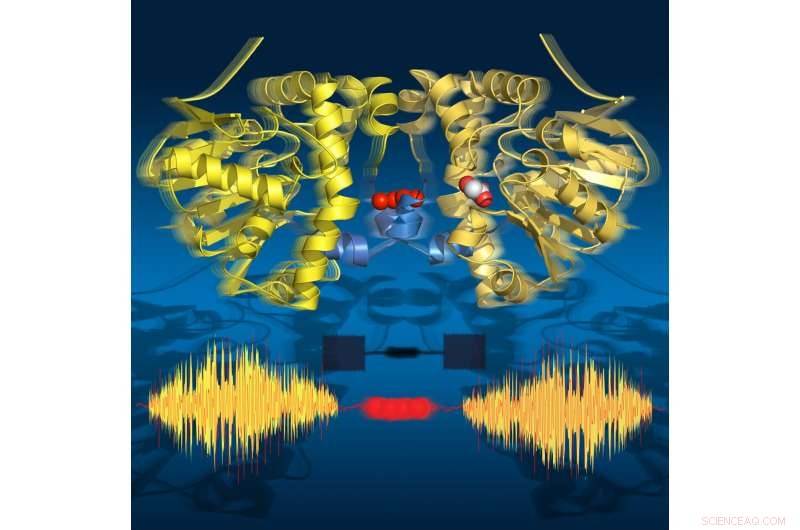
Time-lapse-beelden laten zien dat het enzym 'ademt' tijdens de turnover:het zet uit en krimpt in lijn met de katalytische substappen. De twee helften communiceren via een reeks watermoleculen. Krediet:Joerg M. Harms, MPSD
Onderzoekers van het Department of Atomically Resolved Dynamics van het Max Planck Institute for the Structure and Dynamics of Matter (MPSD) van het Center for Free-Electron Laser Science in Hamburg, de Universiteit van Potsdam (beide in Duitsland) en de Universiteit van Toronto (Canada) hebben een gedetailleerde time-lapse-film samengesteld die alle belangrijke stappen tijdens de katalytische cyclus van een enzym onthult. Verrassend genoeg, de communicatie tussen de eiwiteenheden wordt tot stand gebracht via een waternetwerk dat lijkt op een stringtelefoon. Deze communicatie is afgestemd op een 'ademende' beweging, dat is de uitzetting en samentrekking van het eiwit. Deze time-lapse opeenvolging van structuren onthult dynamische bewegingen als een fundamenteel element in de moleculaire grondslagen van de biologie.
Al het leven is dynamisch en dat geldt ook voor de moleculaire bouwstenen. De bewegingen en structurele veranderingen van biomoleculen zijn fundamenteel voor hun functies. Echter, het begrijpen van deze dynamische bewegingen op moleculair niveau is een enorme uitdaging. Hoe kan een eiwit een chemische reactie versnellen, wat zou jaren duren om verder te gaan zonder hulp?
Hiervoor gebruikten de onderzoekers een enzym dat de sterkste enkelvoudige binding in de organische chemie splitst:de C-F-binding. Gefluoreerde koolstoffen zijn te vinden in materialen zoals Teflon of GoreTex en in veel geneesmiddelen en pesticiden. Gefluoreerde verbindingen hebben een bijzondere invloed op klimaatverandering, overtreft de effectiviteit van CO 2 per ordegrootte. Daarom, het vermogen om de omzet van CF-obligaties beter te begrijpen en uiteindelijk te beheersen, is van bijzonder belang voor klimaatverandering en bioremediatie.
De onderzoekers gebruikten in de tijd opgeloste röntgenkristallografie om moleculaire snapshots te maken tijdens de omzettingsreactie van dit natuurlijke enzym bij fysiologische temperaturen. Deze time-lapse-film onthulde achttien tijdstippen van 30 milliseconden tot 30 seconden, die alle belangrijke katalytische toestanden dekt die leiden tot het verbreken van de C-F-binding. Verrassend genoeg, de film laat ook zien dat het enzym 'ademt' tijdens omzet, dat wil zeggen dat het uitzet en samentrekt in lijn met de katalytische substappen.
Opvallend, de twee helften van het enzym communiceren met elkaar via een reeks watermoleculen die beide helften met elkaar verbindt. Dit waternetwerk stelt de twee helften in staat om met elkaar te 'praten' en informatie te delen over hun katalytische toestand. Dit is cruciaal voor de functie van het enzym, aangezien slechts de helft van het enzym ooit op een bepaald moment actief kan zijn.
Deze dynamische veranderingen zijn cruciaal gebleken voor de functie van het enzym. De onderzoekers verwachten dat veel andere systemen vergelijkbare mechanismen zullen gebruiken voor hun activiteiten.
Hoofdlijnen
- Vrijgelaten zeeschildpad draagt as van oceanografen naar zee
- Schimmelmicroben als biomeststoffen in landbouw en tuinieren:is de beloning groter dan het risico?
- Onderzoekers identificeren moleculaire motor die chromosomen transformeert
- Nu waren gestrest? Geschiedenis toont de oudste emotie
- Hoe de anatomie van een rundvleeshart en een menselijk hart te vergelijken
- Wat is het verschil tussen ras en etniciteit?
- Kweek vers voedsel in uw huis - verticaal
- Waarom doden we?
- Een nieuwe manier om mRNA-genomen af te leveren:nucleocapsiden met evolutionaire eigenschappen
 Een temperatuurbereik berekenen
Een temperatuurbereik berekenen  Autoverkopen VS komen tot leven in maart (update)
Autoverkopen VS komen tot leven in maart (update) Wat als een hond een kippenbot eet?
Wat als een hond een kippenbot eet?  Koolstof gaat met de stroom mee
Koolstof gaat met de stroom mee Voorbereiding versus hulpverlening:inzicht in de publieke steun voor uitgaven voor natuurrampen
Voorbereiding versus hulpverlening:inzicht in de publieke steun voor uitgaven voor natuurrampen Vier dingen die de diffusiesnelheid beïnvloeden
Vier dingen die de diffusiesnelheid beïnvloeden Waarnemingen onthullen de aard van de chemisch eigenaardige ster HD 63401
Waarnemingen onthullen de aard van de chemisch eigenaardige ster HD 63401 Florence zou genoeg regen kunnen dumpen om de Chesapeake Bay te vullen
Florence zou genoeg regen kunnen dumpen om de Chesapeake Bay te vullen
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Portuguese | Swedish | German | Dutch | Norway | Spanish | Danish |

-
Wetenschap © https://nl.scienceaq.com