
Wetenschap
GPS-nanodeeltjesplatform levert nauwkeurig therapeutische lading aan kankercellen
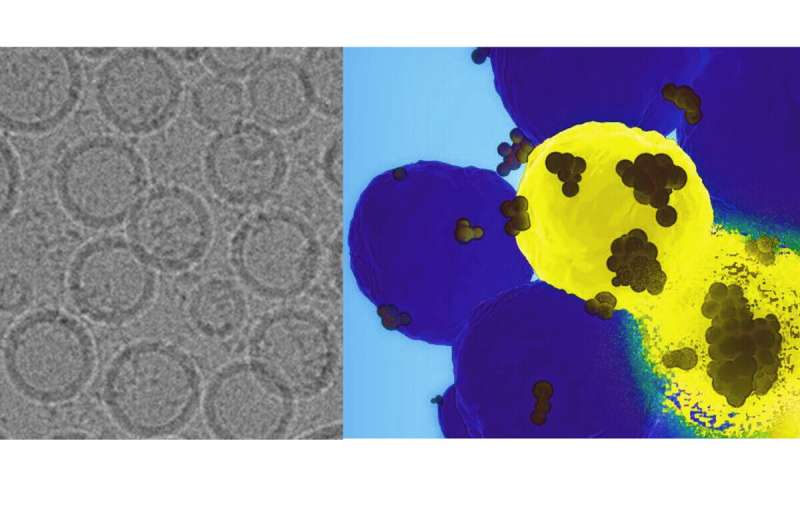
Volgens onderzoekers van Penn State kan een nieuw ontwikkeld 'GPS-nanodeeltje' dat intraveneus wordt geïnjecteerd kankercellen aanvallen en een genetische impuls geven aan het eiwit dat betrokken is bij de groei en verspreiding van tumoren. Ze testten hun aanpak in menselijke cellijnen en bij muizen om een kankerverwekkend gen effectief uit te schakelen, en rapporteerden dat de techniek mogelijk een preciezere en effectievere behandeling zou kunnen bieden voor notoir moeilijk te behandelen basaalachtige borstkankers.
Ze publiceerden hun werk in ACS Nano . Ze dienden ook een voorlopige aanvraag in om de in het onderzoek beschreven technologie te patenteren.
"We hebben een GPS-nanodeeltje ontwikkeld dat de plek kan vinden waar het nodig is", zegt corresponderende auteur Dipanjan Pan, de Dorothy Foehr Huck &J. Lloyd Huck Chair Professor in Nanomedicine en hoogleraar nucleaire engineering en materiaalkunde en engineering aan Penn State .
"Als het eenmaal daar is – en alleen daar – kan het genbewerkingseiwitten leveren om te voorkomen dat de kankercellen zich verspreiden. Het was een moeilijke taak, maar we hebben laten zien dat het systeem werkt bij basaalachtige borstkankers."
Net als bij triple-negatieve borstkankers komen basaalachtige borstkankers misschien minder vaak voor dan andere borstkankers, maar ze kunnen veel moeilijker te behandelen zijn, grotendeels omdat ze de drie therapeutische doelen missen die bij andere borstkankers worden aangetroffen. Het zijn ook vaak agressieve, snelgroeiende tumoren en het afstoten van cellen die zich elders in het lichaam verspreiden. Die cellen kunnen extra tumoren uitzaaien, een proces dat metastase wordt genoemd.
"Metastase is een enorme uitdaging, vooral bij kankers zoals drievoudige negatieve en basaalachtige borstkanker," zei Pan. "De kanker kan moeilijk te detecteren zijn en komt niet naar voren tijdens een routinemammografie, en het treft vooral de jongere of Afro-Amerikaanse bevolking die mogelijk nog geen preventieve zorg ontvangt. De uitkomst kan heel, heel slecht zijn, dus er is een duidelijke onvervulde klinische behoefte aan effectievere behandelingen als de kanker niet vroeg genoeg wordt ontdekt."
Het team vervaardigde een nanodeeltje van een Trojaans paard, vermomde het met speciaal ontworpen vetmoleculen die op natuurlijk voorkomende lipiden lijken en verpakte het vol met CRISPR-Cas9-moleculen. Deze moleculen kunnen zich richten op het genetische materiaal van een cel, een bepaald gen identificeren en het uitschakelen, of het ineffectief maken. In dit geval richtte het systeem zich op menselijke forkhead box c1 (FOXC1), die betrokken is bij het aanzetten tot metastasen.
Pan beschreef de ontwerperlipiden als 'zwitterionisch', wat betekent dat ze een vrijwel neutrale lading op de schaal van het nanodeeltje hebben. Dit voorkomt dat het immuunsysteem van het lichaam het nanodeeltje aanvalt (omdat het is vermomd als een niet-bedreigend, normaal molecuul) en kan helpen de lading vrij te geven, maar alleen wanneer de lipiden de lage pH-omgeving van de kankercel herkennen.
Om ervoor te zorgen dat de lipiden alleen bij die lage pH zouden activeren, hebben de onderzoekers ze ontworpen om hun lading naar positief te verplaatsen zodra ze in de zuurdere micro-omgeving van de tumor terechtkomen, waardoor de lading vrijkomt.
Maar het lichaam is een enorme ruimte, dus hoe konden de onderzoekers ervoor zorgen dat de CRISPR-Cas9-lading het juiste doel bereikte? Om ervoor te zorgen dat het nanodeeltje zich aan de juiste cellen zou binden, bevestigden ze een epitheelceladhesiemolecuul (EpCAM), waarvan bekend is dat het zich hecht aan basaalachtige borstkankercellen.
"Niemand heeft ooit geprobeerd zich te richten op een basaalachtige borstachtige kankercel met een context-responsief toedieningssysteem dat het gen in kwestie genetisch kan uitschakelen," zei Pan. "Wij zijn de eersten die laten zien dat het mogelijk is."
Anderen hebben virale toedieningssystemen ontwikkeld, waarbij een virusdeeltje wordt gekaapt om de behandeling naar de cellen te brengen, en niet-virale toedieningssystemen, waarbij gebruik wordt gemaakt van nanodeeltjes. Het verschil, zegt Pan, voor de aanpak van zijn team is dat het oppervlaktelipide is ontworpen om alleen te reageren in de doelomgeving, waardoor de kans op off-target-afgifte en schade aan gezonde cellen wordt verminderd.
Hij voegde eraan toe dat, omdat het lichaam de lipiden niet als een bedreiging beschouwt, er minder kans is op een immuunreactie, wat ze in hun experimenten hebben gevalideerd.
Het team testte de aanpak eerst in menselijke triple-negatieve borstkankercellen, waarbij werd gevalideerd dat het nanodeeltje het CRISPR/Cas9-systeem in de juiste omgeving zou inzetten. Ze bevestigden dat het nanodeeltje zijn weg naar een tumor in een muismodel zou kunnen vinden, het systeem zou kunnen inzetten en FOXC1 met succes zou kunnen uitschakelen.
Vervolgens zijn de onderzoekers van plan het nanodeeltjesplatform te blijven testen, aldus Pan, met als uiteindelijk doel het klinisch toe te passen bij mensen.
"We onderzoeken ook hoe we de platformtechnologie nog meer kunnen toepassen", zei Pan. "We kunnen de moleculen aan het oppervlak aanpassen, de lading die het draagt, en deze gebruiken om genezing op andere gebieden te bevorderen. Er zit veel potentieel in dit platform."