
Wetenschap
Genoommining leidt tot een nieuw type peptide-prenylatie
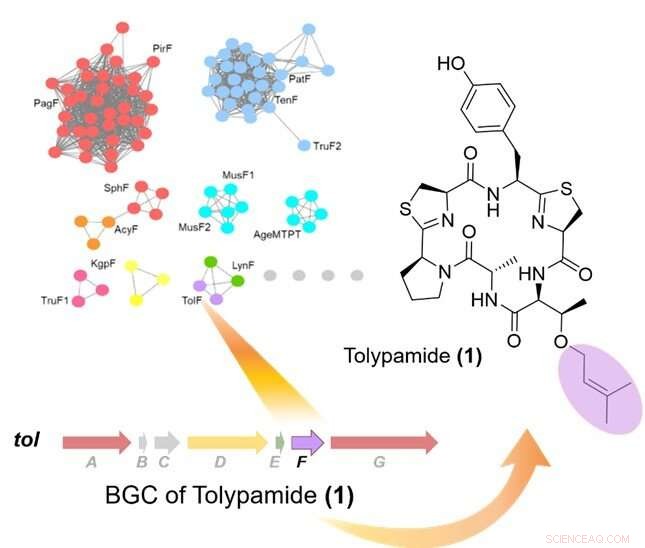
Figuur 1:Gerichte genoommining van prenyltransferasen identificeerde het TolF-enzym en de tol biosynthetische genencluster (BGC). De linkerbovenhoek toont een eiwitsequentie-overeenkomstnetwerk van prenyltransferasen. De biosynthetische genencluster voor de tol route wordt getoond en was gekoppeld aan de biosynthese van tolypamide. Tolypamide bevat een voorwaarts geprenyleerd threonineresidu (paars gekleurd). Krediet:Nationale Universiteit van Singapore
Onderzoekers van NUS gebruikten een genome mining-benadering om een nieuw cyclisch peptide (tolypamide) te identificeren dat is afgeleid van een cyanobacterie. De biosynthese van tolypamide bevat een nieuw type enzym dat in staat is een reeks substraten te prenyleren en potentieel kan worden gebruikt in de farmaceutische chemie en synthetische biologie.
Bioactieve peptiden hebben een sterke positie veroverd op de farmaceutische markt vanwege de talrijke voordelen, zoals een effectieve targeting van eiwit-eiwitinteracties, lage off-target effecten, en lage toxiciteit. Deze voordelen worden vaak aangetast door de slechte biologische beschikbaarheid en celpermeabiliteit. Een manier om de membraanpermeabiliteit te verbeteren is om de lipofiliciteit te verhogen door een alkylketen aan het molecuul toe te voegen (prenylering). Deze transformaties, die kan worden gekatalyseerd door enzymen die betrokken zijn bij de biosynthese van natuurlijke producten van cyanobactine, kan mogelijk de therapeutische werkzaamheid van niet-gemodificeerde peptiden versterken. Ook, cyanobactine-enzymen hebben een brede substraatselectiviteit en werken op een zeer selectieve en specifieke manier met betrekking tot de positie en oriëntatie van de aminozuurresiduen. Het begrijpen van de grondgedachte achter de selectiviteit en specificiteit van deze katalysatoren zal helpen om het vermogen van deze enzymen als biochemische toolkits te benutten.
In samenwerking met een internationaal onderzoeksteam, Prof Brandon Morinaka van de afdeling Farmacie, National University of Singapore ontdekte een nieuw type cyanobactine-enzym dat bekend staat als ToIF. Het vertoont specifieke selectiviteit voor de modificatie van serine- en threonine-residuen in peptiden. Dit werk is een gezamenlijke onderzoeksinspanning met Prof Eric Schmidt van de Universiteit van Utah en Dr. Muriel Gugger van het Institut Pasteur. Eiwitten uit een subfamilie van prenyltransferasen werden in kaart gebracht in een sequentieovereenkomstnetwerk.
De onderzoekers pasten gerichte genoommining toe om de genclusters te analyseren die coderen voor deze eiwitten en identificeerden het ToIF-enzym en de tol-biosynthetische route. Ze ontdekten dat het TolF-enzym betrokken is bij de productie van tolypamide, dat een hydrofobe prenyl-functionele groep aan zijn structuur heeft (Figuur 1). Dergelijke moleculaire aanhechtingen zijn bruikbaar voor het verbeteren van de membraanpermeabiliteit van therapeutische verbindingen. Het TolF-enzym werd functioneel gevalideerd door in vitro biosynthese van het natuurlijke product tolypamide (Figuur 2). Aanvullende biochemische testen tonen aan dat het TolF-enzym ook in staat is om voorwaartse prenylatie op de threonine- en serineresiduen op verschillende synthetische peptiden te vergemakkelijken.
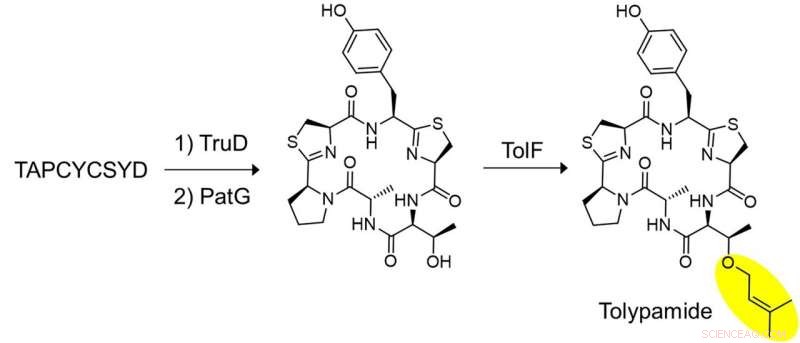
Figuur 2:In vitro biosynthese van tolypamide en functionele validatie van TolF. Een belangrijke reeks experimenten werd uitgevoerd om aan te tonen dat TolF inwerkt op het heterocyclische cyclische peptide. Het gesynthetiseerde peptide, TAPCYCSYD werd achtereenvolgens geïncubeerd met de enzymen, TruD (heterocyclase) en PatG (macrocyclase) om het heterocyclische cyclische peptide te verschaffen. Incubatie met TolF gaf kwantitatieve omzetting in het natuurlijke product tolypamide. Krediet:Nationale Universiteit van Singapore
Daten, het enige andere lid van deze klasse van enzymen (prenyltransferase) waarvan is vastgesteld dat het inwerkt op serine- of threonineresiduen, is TruF1. Echter, zijn slechte oplosbaarheid en lage in vitro activiteit hebben uitgebreide karakterisering verhinderd. De ontdekking van TolF biedt de mogelijkheid om de structurele biologie en evolutie van deze enzymfamilie te bestuderen.
Prof Morinaka zei:"Verdere karakterisering van het TolF-enzym zal een vollediger begrip van de substraatspecificiteit en selectiviteit van prenyltransferasen mogelijk maken. Dit zal de rationele engineering van deze biokatalysatoren als krachtige hulpmiddelen op het gebied van synthetische biologie vergemakkelijken."
 SMART-onderzoekers ontwikkelen snelle en efficiënte methode om rode bloedcellen aan te maken
SMART-onderzoekers ontwikkelen snelle en efficiënte methode om rode bloedcellen aan te maken Hoe wordt Pure Cesium opgeslagen?
Hoe wordt Pure Cesium opgeslagen?  Lab-on-a-chip helpt bij het zoeken naar menselijk DNA op plaats delict
Lab-on-a-chip helpt bij het zoeken naar menselijk DNA op plaats delict Zeer efficiënt, duurzame elektrokatalysator om de productie van waterstofbrandstof te stimuleren
Zeer efficiënt, duurzame elektrokatalysator om de productie van waterstofbrandstof te stimuleren Kader om het pad van individuele koolstofatomen te volgen
Kader om het pad van individuele koolstofatomen te volgen
Hoofdlijnen
- Kunnen eukaryoten overleven zonder mitochondria?
- Morfogenese en de ontwikkeling van levende vormen
- Minimale zuurstofconcentratie voor menselijke ademhaling
- Bloem trekt insecten aan door zich voor te doen als paddenstoel
- Hoe natuurlijke selectie werkt
- Dahls paddenkopschildpad bedreigd door versnipperd leefgebied, krimpende bevolking
- Het Bohr-model:snel vervangen maar nooit vergeten
- Voetafdrukken gebruiken om reuzenpanda's in het wild te identificeren en te volgen
- Wilgenroosje:de roze pionier
- Melkeiwit kan de gezondheid van bosbessen helpen verbeteren

- Zelfassemblerende materialen kunnen patronen vormen die nuttig kunnen zijn in optische apparaten

- Natuurkundigen maken een model om de eigenschappen van elk molecuul te voorspellen

- De zoete smaak van succes voor een ondersteunde nikkelfosfide-nanolegeringskatalysator
- Fullerenen overbruggen geleidende kloof in organische fotovoltaïsche energie
 Doppler-effect: definitie, vergelijking en voorbeeld
Doppler-effect: definitie, vergelijking en voorbeeld  Dorpen geëvacueerd vanwege nieuwe bosbranden in Griekenland
Dorpen geëvacueerd vanwege nieuwe bosbranden in Griekenland Experimenten doen twijfel rijzen over hoe de aarde is gevormd
Experimenten doen twijfel rijzen over hoe de aarde is gevormd Het stabiliseren van het voorstel zonder grenzen werpt licht op de kwantumoorsprong van het universum
Het stabiliseren van het voorstel zonder grenzen werpt licht op de kwantumoorsprong van het universum Onderzoekers lieten bijna de oplossing van een wiskundig raadsel wegglippen
Onderzoekers lieten bijna de oplossing van een wiskundig raadsel wegglippen Natuurkundigen duwen atomen binnen minder dan een biljoenste van een seconde
Natuurkundigen duwen atomen binnen minder dan een biljoenste van een seconde Hoe een pH-indicator te maken met kool
Hoe een pH-indicator te maken met kool Kleine sterrenstelsels speelden waarschijnlijk een belangrijke rol in de evolutie van het heelal
Kleine sterrenstelsels speelden waarschijnlijk een belangrijke rol in de evolutie van het heelal
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

