
Wetenschap
Ingenieurs ontwikkelen een nieuwe methode voor het vervaardigen van CAR T-cellen met behulp van lipide nanodeeltjes
Voor patiënten met bepaalde soorten kanker is CAR T-celtherapie niets minder dan levensveranderend. CAR T-celtherapie, gedeeltelijk ontwikkeld door Carl June, Richard W. Vague Professor aan de Perelman School of Medicine, en goedgekeurd door de Food and Drug Administration (FDA) in 2017, mobiliseert het eigen immuunsysteem van patiënten om onder meer lymfomen en leukemie te bestrijden. andere vormen van kanker.
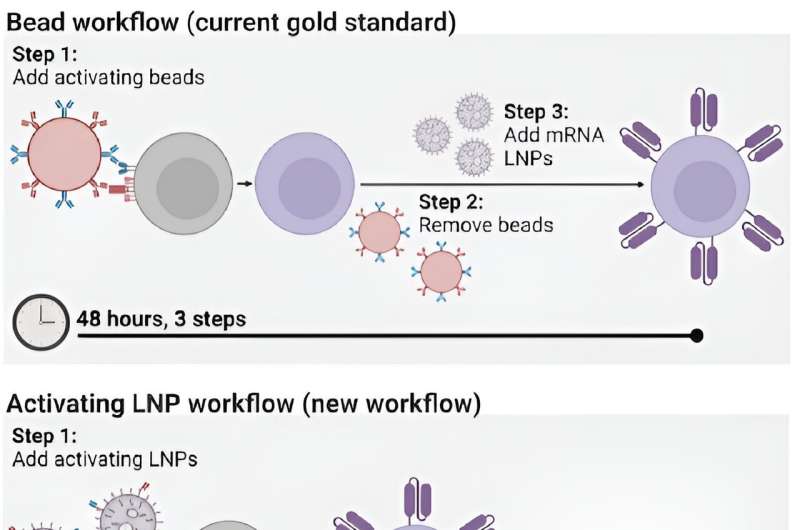
Het proces voor het vervaardigen van CAR T-cellen zelf is echter tijdrovend en kostbaar, en vereist meerdere stappen gedurende een dag. Het proces omvat het extraheren van de T-cellen van patiënten en deze vervolgens activeren met kleine magnetische korrels, voordat de T-cellen genetische instructies krijgen om chimere antigeenreceptoren (CAR's) te maken, de gespecialiseerde receptoren die T-cellen helpen kankercellen te elimineren.
Nu hebben Penn Engineers een nieuwe methode ontwikkeld voor de productie van CAR T-cellen, een die slechts 24 uur duurt en slechts één stap vereist, dankzij het gebruik van lipide nanodeeltjes (LNP's), de krachtige leveringsvoertuigen die een cruciale rol speelden in de Moderna en Pfizer-BioNTech COVID-19-vaccins.
In een nieuw artikel gepubliceerd in Advanced Materials beschrijft Michael J. Mitchell, universitair hoofddocent bio-engineering, de creatie van ‘activerende lipide-nanodeeltjes’ (aLNP’s), die T-cellen kunnen activeren en de genetische instructies voor CAR’s in één stap kunnen afleveren. vereenvoudiging van het productieproces van CAR T-cellen.
"We wilden deze twee uiterst veelbelovende onderzoeksgebieden combineren", zegt Ann Metzloff, promovendus en graduate research fellow in het Mitchell-lab en hoofdauteur van het artikel. "Hoe kunnen we lipide-nanodeeltjes toepassen op CAR T-celtherapie?"
In sommige opzichten functioneren T-cellen als een militaire reserve-eenheid:in tijden van goede gezondheid blijven ze inactief, maar wanneer ze ziekteverwekkers detecteren, mobiliseren ze zich, waardoor hun aantal snel toeneemt voordat ze zich tot de dreiging wenden. Kanker vormt een unieke uitdaging voor deze verdedigingsstrategie. Omdat kankercellen van het lichaam zijn, behandelen T-cellen kanker niet automatisch als gevaarlijk. Vandaar de noodzaak om eerst T-cellen te "activeren" en kankerdetecterende CAR's af te leveren in CAR T-celtherapie.
Tot nu toe was de meest efficiënte manier om T-cellen te activeren het extraheren ervan uit de bloedbaan van een patiënt en het vervolgens mengen van die cellen met magnetische korrels die vastzaten aan specifieke antilichamen – moleculen die een immuunreactie uitlokken. "De kralen zijn duur", zegt Metzloff. "Ze moeten ook met een magneet worden verwijderd voordat je de T-cellen klinisch kunt toedienen. Maar daarbij verlies je eigenlijk ook veel van de T-cellen."
Lipide-nanodeeltjes zijn voornamelijk gemaakt van lipiden, dezelfde waterafstotende moleculen die huishoudelijke bakvetten vormen, zoals boter en olijfolie, en zijn enorm effectief gebleken in het leveren van delicate moleculaire ladingen. Hun capsuleachtige vorm kan mRNA omsluiten en beschermen, wat instructies geeft aan cellen om eiwitten te produceren. Vanwege het wijdverbreide gebruik van de COVID-19-vaccins, zegt Metzloff, “is de veiligheid en werkzaamheid van lipidenanodeeltjes bij miljarden mensen over de hele wereld aangetoond.”
Om LNP's te integreren in de productie van CAR T-cellen, vroegen Metzloff en Mitchell zich af of het mogelijk zou zijn om de activerende antilichamen die op de magnetische kralen worden gebruikt, rechtstreeks aan het oppervlak van de LNP's te hechten. Door op deze manier LNP's te gebruiken, dachten ze, zou het mogelijk kunnen worden gemaakt om de noodzaak voor het activeren van kralen in het productieproces helemaal te elimineren. "Dit is nieuw", zegt Metzloff, "omdat we lipide-nanodeeltjes niet alleen gebruiken om mRNA-coderende CAR's af te leveren, maar ook om een voordelige activeringstoestand te initiëren."
In de loop van twee jaar heeft Metzloff het ontwerp van de aLNP's zorgvuldig geoptimaliseerd. Een van de belangrijkste uitdagingen was het vinden van de juiste verhouding tussen het ene antilichaam en het andere. "Er moesten veel keuzes worden gemaakt", herinnert Metzloff zich, "aangezien dit nog niet eerder was gedaan."
Door de antilichamen rechtstreeks aan LNP's te hechten, konden de onderzoekers het aantal stappen in het productieproces van CAR T-cellen terugbrengen van drie naar één, en de benodigde tijd halveren, van 48 uur naar slechts 24 uur. "Dit zal hopelijk een transformerend effect hebben op het proces voor de productie van CAR T-cellen", zegt Mitchell. "Het kost momenteel zoveel tijd om ze te maken, en daarom zijn ze niet toegankelijk voor veel patiënten over de hele wereld die ze nodig hebben."
CAR T-cellen vervaardigd met behulp van aLNP's moeten nog worden getest op mensen, maar in muismodellen hadden CAR T-cellen gemaakt met behulp van het proces dat in het artikel wordt beschreven een significant effect op leukemie, waardoor de omvang van tumoren werd verkleind, waardoor de haalbaarheid van de technologie werd aangetoond. .
Metzloff ziet ook extra potentieel voor aLNP's. "Ik denk dat aLNP's breder kunnen worden onderzocht als platform om andere ladingen aan T-cellen te leveren", zegt ze. "We hebben in dit artikel één specifieke klinische toepassing gedemonstreerd, maar lipidenanodeeltjes kunnen worden gebruikt om veel verschillende dingen in te kapselen:eiwitten, verschillende soorten mRNA. De aLNP's hebben een breed potentieel nut voor T-celkankertherapie als geheel, buiten dit ene mRNA." CAR T-celtoepassing die we hier hebben laten zien."