
Wetenschap
Lama-nanobodies kunnen de sleutel zijn tot het voorkomen van dodelijke post-transplantatie-infecties
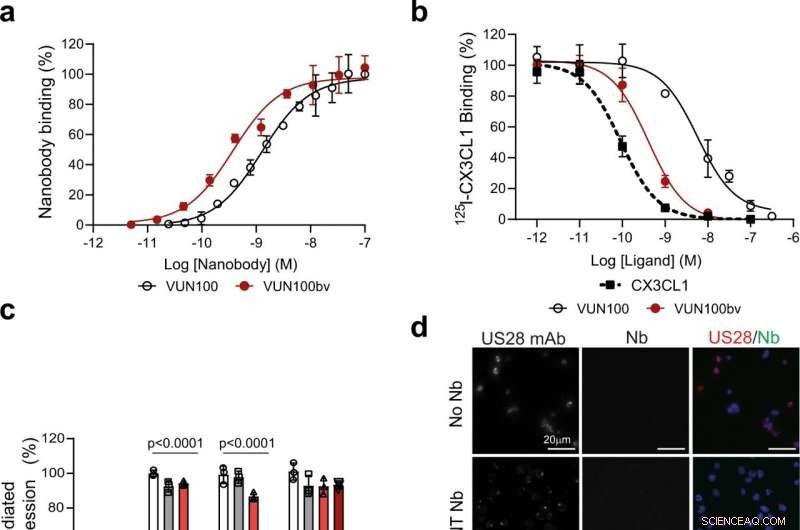
Fig. 1:VUN100bv bindt en remt US28-signalering. een ELISA-binding van monovalent VUN100 en bivalent VUN100bv aan membraanextracten van HEK293T-cellen die US28 tot expressie brengen. Representatieve figuur van drie onafhankelijke experimenten. B Verplaatsing van 125I-CX3CL1 van membranen die US28 tot expressie brengen door ongelabelde ligand of de nanobodies VUN100 en VUN100bv. Representatieve figuur van drie onafhankelijke experimenten. C Effect van nanobodies op US28-gemedieerde NFAT (nucleaire factor van geactiveerde T-cellen) activering. HEK293T-cellen die alleen NFAT-luciferase-reporter (Mock) of NFAT-luciferase-reporter samen met US28-wildtype-receptor (WT) tot expressie brengen, US28 Y16F-mutant (Y16F), US28 ΔN (2-22) mutant (ΔN (2-22)) of US28 R129A-mutant (R129A). Cellen waren onbehandeld (untr) of behandeld met een non-targeting nanobody (NT Nb), VUN100, of VUN100bv gedurende 24 h voorafgaand aan de luminescentiemeting. Gegevens werden genormaliseerd naar de onbehandelde WT-monsters. Representatieve figuur van drie onafhankelijke experimenten. NS Immunofluorescentiemicroscopie van nanobody-binding aan US28 tot expressie brengende THP-1-cellen. US28 werd gedetecteerd met behulp van een polyklonaal konijn-anti-US28-antilichaam (US28 mAb). Cellen werden geïncubeerd zonder nanobody (No Nb), een NT Nb, VUN100, of VUN100bv. Gebonden nanobody werd gedetecteerd met behulp van de Myc-tag die aanwezig was op de nanobodies en een anti-Myc-antilichaam (Nb). Representatieve figuur van drie onafhankelijke experimenten. e Western-blotdetectie voor totale IFI16-niveaus van lysaten van onbehandelde THP-1-schijngetransduceerde cellen (THP-1 Mock) of THP-1-cellen die US28 tot expressie brengen (THP-1 US28 WT). THP-1 US28 WT-cellen waren onbehandeld (Untr) of behandeld met NT Nb, VUN100, of VUN100bv voor 48 h. IFI16-eiwitniveaus werden bepaald en genormaliseerd naar actine-eiwitniveaus. Relatieve IFI16-eiwitniveaus werden genormaliseerd naar onbehandelde THP-1-schijncellysaten. n = 3 onafhankelijke experimenten van drie onafhankelijke biologische replica's. Alle gegevens zijn uitgezet als gemiddelde ± S.D. Voor alle gegevens, behalve voor Fig. 1c, statistische analyses werden uitgevoerd met behulp van een ongepaarde tweezijdige t-test. Voor afb. 1c, statistische significantie werd bepaald met behulp van de Holm-Sidak-methode (tweezijdig met alpha = 0.05). Brongegevens worden geleverd als een brongegevensbestand. Krediet:DOI:10.1038/s41467-021-24608-5
Wetenschappers hebben een "nanobody" ontwikkeld - een klein fragment van een lama-antilichaam - dat in staat is om het humaan cytomegalovirus (HCMV) te verjagen terwijl het zich verbergt voor het immuunsysteem. Hierdoor kunnen immuuncellen dit potentieel dodelijke virus opsporen en vernietigen.
Ongeveer vier op de vijf mensen in het VK zijn vermoedelijk besmet met HCMV, en in ontwikkelingslanden kan dit oplopen tot 95%. Voor de meerderheid van de mensen, het virus blijft slapen, verborgen in witte bloedcellen, waar het tientallen jaren ongestoord en onopgemerkt kan blijven. Als het virus opnieuw wordt geactiveerd bij een gezond persoon, het veroorzaakt meestal geen symptomen. Echter, voor mensen die immuungecompromitteerd zijn, bijvoorbeeld ontvangers van transplantaties die immunosuppressiva moeten gebruiken om afstoting van organen te voorkomen - HCMV-reactivering kan verwoestend zijn.
Momenteel, er is geen effectief vaccin tegen HCMV, en antivirale middelen blijken vaak niet effectief of hebben zeer ernstige bijwerkingen.
Nutsvoorzieningen, in een studie gepubliceerd in Natuurcommunicatie , Onderzoekers van de Vrije Universiteit Amsterdam en de Universiteit van Cambridge hebben een manier gevonden om het virus uit zijn schuilplaats te verjagen met behulp van een speciaal type antilichaam dat bekend staat als een nanobody.
Nanobodies werden voor het eerst geïdentificeerd bij kamelen en komen voor in alle kameelachtigen - een familie van dieren die ook dromedarissen, lama's en alpaca's. Menselijke antilichamen bestaan uit twee zware en twee lichte ketens van moleculen, die samen markers op het oppervlak van een cel of virus herkennen en eraan binden die bekend staan als antigenen. Voor deze speciale klasse van kameelachtige antilichamen, echter, slechts een enkel fragment van het antilichaam - vaak aangeduid als antilichaam met één domein of nanobody - is voldoende om antigenen goed te herkennen.
Dr. Timo De Groof van de Vrije Universiteit Amsterdam, de gezamenlijke eerste auteur van de studie, zei:"Zoals de naam al doet vermoeden, nanobodies zijn veel kleiner dan gewone antilichamen, waardoor ze perfect geschikt zijn voor bepaalde soorten antigenen en relatief eenvoudig te vervaardigen en aan te passen. Daarom worden ze geprezen omdat ze het potentieel hebben om een revolutie teweeg te brengen in antilichaamtherapieën."
Het eerste nanobody is goedgekeurd en op de markt gebracht door biofarmaceutisch bedrijf Ablynx, terwijl andere nanobodies al in klinische proeven zijn voor ziekten zoals reumatoïde artritis en bepaalde vormen van kanker. Nutsvoorzieningen, het team in Nederland en het VK hebben nanobodies ontwikkeld die zich richten op een specifiek viruseiwit (US28), een van de weinige elementen die detecteerbaar zijn op het oppervlak van een latent geïnfecteerde HCMV-cel en een belangrijke aanjager van deze latente toestand.
Dr. Ian Groves van de afdeling Geneeskunde van de Universiteit van Cambridge zei:"Ons team heeft aangetoond dat nanobodies die zijn afgeleid van lama's het potentieel hebben om het menselijk cytomegalovirus te slim af te zijn. Dit kan erg belangrijk zijn omdat het virus levensbedreigende complicaties kan veroorzaken bij mensen bij wie immuunsysteem werkt niet goed."
Bij laboratoriumexperimenten waarbij met het virus besmet bloed werd gebruikt, het team toonde aan dat het nanobody zich bindt aan het US28-eiwit en de signalen onderbreekt die via het eiwit tot stand worden gebracht en die helpen het virus in zijn slapende toestand te houden. Zodra deze controle is verbroken, de lokale immuuncellen kunnen 'zien' dat de cel geïnfecteerd is, waardoor de immuuncellen van de gastheer het virus kunnen opsporen en doden, het latente reservoir zuiveren en het bloed van het virus zuiveren.
Dr. Elizabeth Elder, gezamenlijke eerste auteur, die haar werk uitvoerde aan de Universiteit van Cambridge, zei:"Het mooie van deze aanpak is dat het het virus net genoeg reactiveert om het zichtbaar te maken voor het immuunsysteem, maar niet genoeg om te doen wat een virus normaal doet:repliceren en verspreiden. Het virus wordt gedwongen om zijn kop boven de borstwering te steken, waar het vervolgens door het immuunsysteem kan worden gedood."
Professor Martine Smit, ook van de Vrije Universiteit Amsterdam, toegevoegd:"Wij geloven dat onze aanpak zou kunnen leiden tot een hoognodig nieuw type behandeling voor het verminderen en mogelijk zelfs voorkomen van CMV-infectieus bij patiënten die in aanmerking komen voor orgaan- en stamceltransplantatie."
 Met een keukenvriezer en plantaardige cellulose, een aerogel voor therapeutisch gebruik is ontwikkeld
Met een keukenvriezer en plantaardige cellulose, een aerogel voor therapeutisch gebruik is ontwikkeld Nieuwe inkjetprintmethode kan het ontdekken van medicijnen en geprinte gepersonaliseerde medicijnafgifte versnellen
Nieuwe inkjetprintmethode kan het ontdekken van medicijnen en geprinte gepersonaliseerde medicijnafgifte versnellen Kan olie en zuurstof ontbranden zonder een vonk?
Kan olie en zuurstof ontbranden zonder een vonk?  Depressie, zwaarlijvigheid, chronische pijn kan worden behandeld door zich op hetzelfde belangrijke eiwit te richten
Depressie, zwaarlijvigheid, chronische pijn kan worden behandeld door zich op hetzelfde belangrijke eiwit te richten Bier brouwen dat langer vers smaakt
Bier brouwen dat langer vers smaakt
 Hoe is de luchtkwaliteit beïnvloed door de Amerikaanse fracking-boom?
Hoe is de luchtkwaliteit beïnvloed door de Amerikaanse fracking-boom? Salvors beginnen met zinkend schip dat voor Mauritius aan de grond liep
Salvors beginnen met zinkend schip dat voor Mauritius aan de grond liep Families uit 8 landen klagen EU aan wegens klimaatverandering
Families uit 8 landen klagen EU aan wegens klimaatverandering Afvalwaterslib omzetten in energie en minerale zouten
Afvalwaterslib omzetten in energie en minerale zouten Zeegrasweiden - een onderwatertijdcapsule voor archeologie
Zeegrasweiden - een onderwatertijdcapsule voor archeologie
Hoofdlijnen
- Drie voorbeelden van protisten met wetenschappelijke namen
- DNA-onderzoek in de Stille Oceaan onthult een toename van 2000 procent in onze kennis van de biodiversiteit van weekdieren
- Hoe een 3D-model van een plantencel te maken
- Nieuwe studie benadrukt de effecten van een wereldwijde strategie om de antibioticaconsumptie in de productie van voedseldieren te verminderen
- De genetica van Biracial-kenmerken
- Wat is Serum?
- Central Dogma (Gene Expression): Definitie, Stappen, Verordening
- Is het DNA tussen genen echt rommel?
- Theorie van de evolutie van geslachten getest met algen
- Kleurrijk, magnetische Janus-ballen kunnen valsemunters helpen verijdelen

- Microscopische nanoflessen bieden blauwdruk voor verbeterde biologische beeldvorming

- Nieuw onderzoek toont aan dat kaarsroet de lithiumbatterijen in elektrische auto's van stroom kan voorzien

- Onderzoek naar defecten in apparaten op nanoschaal voor mogelijke kwantumcomputertoepassingen

- Natuurkundigen ontwikkelen nieuwe techniek om slimme materialen te doorgronden
 Sterk en kneedbaar Damascus-staal door additieve fabricage
Sterk en kneedbaar Damascus-staal door additieve fabricage Ideeën voor Cookie Science Fair Projects
Ideeën voor Cookie Science Fair Projects Praten als een vrouw in TED Talks wordt geassocieerd met meer populariteit
Praten als een vrouw in TED Talks wordt geassocieerd met meer populariteit Feiten over Buzzards
Feiten over Buzzards  Analyse toont de tol van de pandemie aan werknemers met een hoog risico
Analyse toont de tol van de pandemie aan werknemers met een hoog risico Hoe hebben Watson en Crick baseparing bepaald?
Hoe hebben Watson en Crick baseparing bepaald?  Een systeem om hypnagogische microdromen te beïnvloeden
Een systeem om hypnagogische microdromen te beïnvloeden Simulaties lokaliseren defecten op atomair niveau in nanostructuren van zonnecellen
Simulaties lokaliseren defecten op atomair niveau in nanostructuren van zonnecellen
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway | Italian |

-
Wetenschap © https://nl.scienceaq.com

