
Wetenschap
Structuur van eiwit nanoturbine onthuld

Elke eiwitsubeenheid heeft een andere kleur. V1-domein is top, Vo bodem, perifere stengels links en rechts. De achtergrond toont een door de wind aangedreven waterpomp. Krediet:IST Oostenrijk, 2019
Cellen vertrouwen op eiwitcomplexen die bekend staan als ATP-synthasen of ATPasen voor hun energiebehoeften. Adenosinetrifosfaat (ATP)-moleculen sturen de meeste processen aan die het leven in stand houden. Structuurbioloog Professor Leonid Sazanov en zijn onderzoeksgroep van het Institute of Science and Technology Austria (IST Austria) in Klosterneuburg, Oostenrijk heeft nu de eerste atomaire structuur bepaald van de vertegenwoordiger van de V/A-ATPase-familie, de leemte opvullen in de evolutionaire boom van deze essentiële moleculaire machines. Deze resultaten verkregen met behulp van de nieuwste cryo-elektronenmicroscopiemethoden onthulden een vergelijkbare structuur van het enzym in een turbine of watermolen en zijn nu gepubliceerd in het tijdschrift Wetenschap .
Roterende macht
ATP-synthasen/ATPasen zijn grote membraaneiwitcomplexen die algemene bouwplannen en roterende katalysemechanismen delen. Deze eiwitfamilie omvat het F-type enzym dat wordt aangetroffen in mitochondriën (krachtfabrieken van de cel), chloroplasten (organellen die fotosynthese in planten uitvoeren) en bacteriën; V (vacuolair) type gevonden in intracellulaire compartimenten in eukaryoten (hogere organismen met een kern) en A (archaea) type gevonden in prokaryoten - archaea (oude micro-organismen) en sommige bacteriën.
Verschillende smaken ATPases
F- en A-type enzymen werken gewoonlijk om ATP te produceren, aangedreven door protonenstroom over het membraan. V-type enzymen werken meestal omgekeerd, met behulp van ATP om protonen te pompen. V- en A-ATPasen zijn structureel vergelijkbaar, maar ze verschillen van het F-type door twee of drie perifere stengels en extra verbindende eiwitsubeenheden tussen V1 en Vo. V-type enzymen zijn waarschijnlijk geëvolueerd uit het A-type en vanwege deze overeenkomsten wordt het A-type ook V/A-ATPase genoemd. Sommige bacteriën, inclusief Thermus thermophilus , een A-type enzym verworven. Lange Zhou, postdoc in de Sazanov onderzoeksgroep van IST Oostenrijk, heeft dit enzym (ThV1Vo) gezuiverd en bestudeerd met cryo-EM. In tegenstelling tot het F-type, voor V-type ATPasen werden eerder alleen de structuren van de geïsoleerde V1- en Vo-domeinen bepaald. Hoe V1 aan Vo is gekoppeld was dus niet bekend, en de kennis over de volledige katalytische cyclus ontbrak.
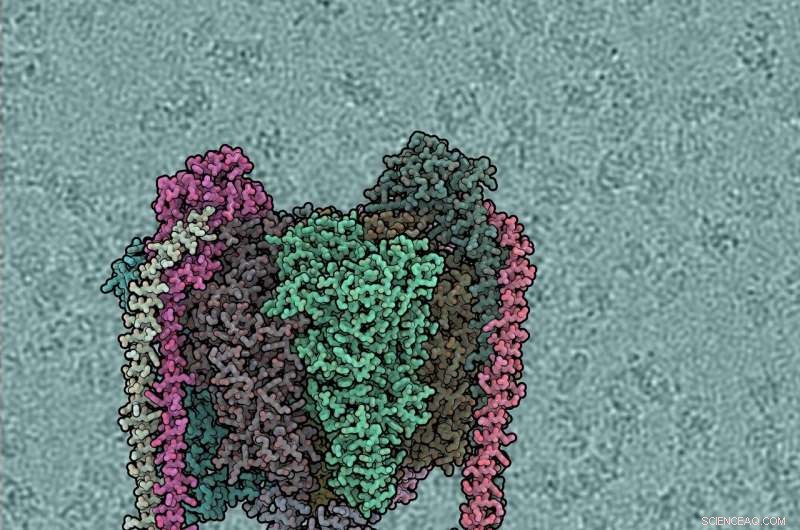
Elke eiwitsubeenheid heeft een andere kleur. V1-domein is top, Vo bodem, perifere stengels links en rechts. De achtergrond toont een ruwe cryo-EM-microfoto, met individuele ATPase-moleculen zichtbaar. Krediet:IST Oostenrijk, 2019
Plasticiteit en concurrentie
De wetenschappers bepaalden niet één, maar in totaal vijf structuren van het gehele ThV1Vo-enzym, met behulp van cryo-elektronenmicroscopiemethoden die recentelijk zijn ontwikkeld in de zogenaamde "resolutierevolutie" van deze techniek. De structuren vertegenwoordigen verschillende conformationele toestanden van het enzym die verschillen door de positie van de rotor in de stator. Globale conformationele plasticiteit van ThV1Vo wordt onthuld als substantiële V1 die in de ruimte wiebelt tijdens de overgang van de ene toestand naar de andere. Het is een resultaat van mechanische concurrentie tussen rotatie van de gebogen centrale rotor en stijfheid van de stator. V1-Vo-koppeling wordt bereikt via een nauwe structurele en elektrostatische overeenkomst tussen de as en de specifieke subeenheid van het V-type die deze verbindt met de c-ring. De visualisatie van het protonpad onthulde significante verschillen in de verdeling van geladen eiwitresiduen van die in F-ATPases, met een strenger "controlepunt" dat "wegglijden" van het enzym voorkomt.
Waarom extra complexiteit?
In plaats van een enkele perifere stengel van F-type enzymen, A-types zoals ThV1Vo hebben twee perifere stelen, terwijl eukaryote V-types er drie hebben. Maar wat is het voordeel van de extra complexiteit in de toch al zeer grote eiwitassemblage, samen met extra subeenheden die V1 en Vo? Het F1/V1-domein heeft een drievoudige symmetrie en dus wordt één ATP-molecuul geproduceerd (of verbruikt) per elke 120 ° rotatie van de stator in F1/V1. Professor Leonid Sazanov zegt:"In V/A-ATPases is deze stap een eenmalige rotatie van 120°, in tegenstelling tot F-ATP-synthase waar het is verdeeld in verschillende substappen. Dus, grotere plasticiteit kan nodig zijn in ThV1Vo om deze 120°-stappen in V1 te koppelen aan kleinere per c-subeenheidstappen in de Vo c12-ring. Deze extra flexibiliteit kan in V-types worden geboden door de extra perifere stengels en verbindende subeenheden. Onze nieuwe structuren laten zien hoe dit wordt bereikt, het bieden van een raamwerk voor de hele V-ATPase-familie".
 Wetenschappers creëren een nieuw type intelligent materiaal
Wetenschappers creëren een nieuw type intelligent materiaal Optisch keramiek ontmoet metaal-organische kaders
Optisch keramiek ontmoet metaal-organische kaders Blauw pigment van kunstmatige schimmels kan de textielindustrie groener maken
Blauw pigment van kunstmatige schimmels kan de textielindustrie groener maken Voorkomen, genezing van tandbederf met een bioactief peptide
Voorkomen, genezing van tandbederf met een bioactief peptide Molecuullaag helpt chemoselectieve hydrogenering op vaste palladiumkatalysatoren
Molecuullaag helpt chemoselectieve hydrogenering op vaste palladiumkatalysatoren
Hoofdlijnen
- Hoe permeabiliteit uit te leggen
- Fysische structuur van chromosomen
- Waar bestaat het cytoplasma uit?
- Laat mijn brein me dingen kopen die ik niet nodig heb?
- Onderzoekers verkrijgen gegevens over de ontwikkeling van kippenembryo's
- De oudste kleur van de aarde was roze
- Hoe de droogrot Serpula lacrymans zich aanpasten aan een nieuwe ecologische habitat
- Hoe duplicaten in twee rijen in OpenOffice te verwijderen
- Onderzoekers ontdekken wat er bij libellen op het menu staat
- Eenstapsbenadering voor het construeren van elektromagnetische metamaterialen maakt gebruik van kleine zelf-geassembleerde pilaren in composietfilms

- Onderzoekers gebruiken nanocellulose om materialen met nieuwe eigenschappen te maken
- Hoogtepunt:nanopatronen van grafeen
- Microanalysetechniek maakt optimaal gebruik van kleine nanodeeltjesmonsters

- Nanorobots kunnen zich richten op kankers en bloedstolsels verwijderen
 Biologische signaalprocessen in intelligente materialen
Biologische signaalprocessen in intelligente materialen Voordelen en nadelen van Polymer Composites
Voordelen en nadelen van Polymer Composites Hittestress in de VS kan tegen het einde van de eeuw verdubbelen
Hittestress in de VS kan tegen het einde van de eeuw verdubbelen Door nieuwe technologie kunnen belangrijke metalen efficiënter worden gemaakt
Door nieuwe technologie kunnen belangrijke metalen efficiënter worden gemaakt Indringende microscopisch kleine bewegingen in squishy materialen
Indringende microscopisch kleine bewegingen in squishy materialen Zeefdruk, nPERT-zonnecellen met groot oppervlak overtreffen de efficiëntie van 23 procent
Zeefdruk, nPERT-zonnecellen met groot oppervlak overtreffen de efficiëntie van 23 procent Steden kunnen groeien zonder riffen en oceanen te slopen. Hier is hoe
Steden kunnen groeien zonder riffen en oceanen te slopen. Hier is hoe Hoe armoede te verminderen en mensen opnieuw te verbinden met de natuur
Hoe armoede te verminderen en mensen opnieuw te verbinden met de natuur
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

