
Wetenschap
Gebruik van injecteerbare zelf-geassembleerde nanomaterialen voor langdurige afgifte van medicijnen
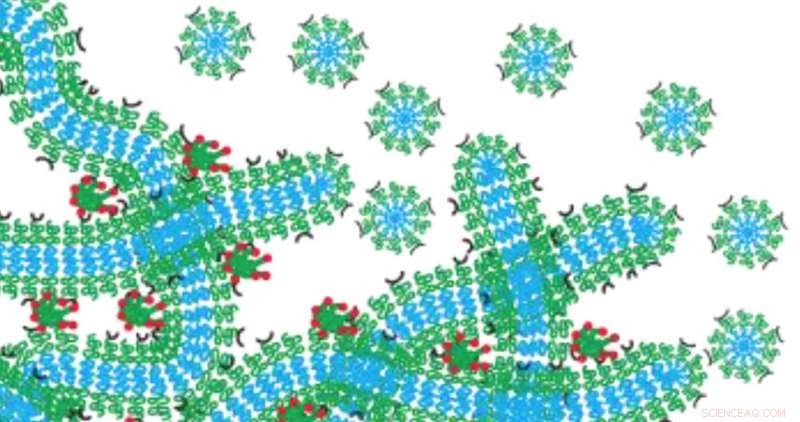
Het hydrogelnetwerk van Evan Scott functioneert als een drugsdepot dat langzaam afbreekt door in micellen af te breken. Krediet:Northwestern University
Omdat ze kunnen worden geprogrammeerd om door het lichaam te reizen en zich selectief op kanker en andere ziekteplaatsen te richten, voertuigen op nanometerschaal, nanocarriers genaamd, kunnen hogere concentraties medicijnen afgeven om specifieke delen van het lichaam te bombarderen, terwijl systemische bijwerkingen worden geminimaliseerd. Nanodragers kunnen ook medicijnen en diagnostische middelen afleveren die doorgaans niet oplosbaar zijn in water of bloed en de effectieve dosering aanzienlijk verlagen.
Hoewel deze methode ideaal lijkt voor de behandeling van ziekten, nanodragers zijn niet zonder hun uitdagingen.
"Gecontroleerd, aanhoudende levering is voordelig voor de behandeling van veel chronische aandoeningen, maar dit is moeilijk te bereiken met nanomaterialen zonder ongewenste lokale ontstekingen te veroorzaken, " zei Evan Scott van de Northwestern University. "In plaats daarvan, nanomaterialen worden meestal toegediend als meerdere afzonderlijke injecties of als een transfusie die langer dan een uur kan duren. Het zou geweldig zijn als artsen één injectie zouden kunnen geven, die gedurende een gecontroleerde periode continu nanomaterialen afgeeft."
Nu Scott, een assistent-professor biomedische technologie aan de McCormick School of Engineering van Northwestern, heeft een nieuw mechanisme ontwikkeld dat ervoor zorgt dat gecontroleerd, duurzame levering mogelijk.
Scott's team ontwierp een nanocarrier-formulering die - na snel tot een gel te zijn gevormd in het lichaam op de injectieplaats - maandenlang continu met medicijnen beladen voertuigen op nanoschaal kan afgeven. De gel zelf assembleert opnieuw in de nanodragers, dus nadat al het medicijn is afgeleverd, er blijft geen restmateriaal over om ontstekingen of fibreuze weefselvorming te veroorzaken. Dit systeem zou, bijvoorbeeld, vaccins met eenmalige toediening mogelijk te maken waarvoor geen boosters nodig zijn, evenals een nieuwe manier om chemotherapie toe te dienen, hormoontherapie, of medicijnen die wondgenezing vergemakkelijken.
Ondersteund door de National Science Foundation en National Institutes of Health, het onderzoek is vandaag online gepubliceerd, 12 februari in het journaal Natuurcommunicatie . Nicolaas Karabin, een afgestudeerde student in het laboratorium van Scott, was de eerste auteur van het papier. Kenneth Shull van Northwestern Engineering, hoogleraar materiaalkunde en techniek, droeg ook bij aan het werk. Een lid van Northwestern's Simpson Querrey Institute for BioNanotechnology and Chemistry of Life Processes Institute, Scott was corresponderend auteur en leidde de ontwikkeling van nanodeeltjes en in vivo validatie.
Momenteel, de meest voorkomende aanhoudende nanocarrier-afgiftesystemen bevatten nanomaterialen in polymeermatrices. Deze netwerken worden in het lichaam geïmplanteerd, waar ze de opgesloten medicijndragers gedurende een bepaalde periode langzaam vrijgeven. Het probleem ligt nadat de levering is voltooid:de netwerken blijven in het lichaam, vaak een reactie van een vreemd lichaam uitlokken. Het overgebleven netwerk kan ongemak en chronische ontstekingen bij de patiënt veroorzaken.
Om dit probleem te omzeilen, Scott ontwikkelde een nanocarrier met behulp van zelf-geassembleerde, filamentvormige nanomaterialen, die zijn geladen met een medicijn of beeldvormend middel. Wanneer ze aan elkaar worden verknoopt, de filamenten vormen een hydrogelnetwerk dat lijkt op structureel weefsel in het menselijk lichaam. Nadat de filamenten in het lichaam zijn geïnjecteerd, het resulterende hydrogelnetwerk functioneert als een medicijndepot dat langzaam afbreekt door op te splitsen in bolvormige nanomaterialen die micellen worden genoemd, die zijn geprogrammeerd om naar specifieke doelen te reizen. Omdat het netwerk verandert in het medicijnafgiftesysteem, niets is minder achter om ontstekingen te veroorzaken.
"Al het materiaal houdt het medicijn vast en geeft het dan af, Scott legde uit. "Het degradeert op een gecontroleerde manier, wat resulteert in nanomaterialen die van gelijke vorm en grootte zijn. Als we een medicijn in de filamenten laden, de micellen nemen het medicijn en gaan ermee weg."
Na het systeem zowel in vitro als in vivo te hebben getest in een diermodel, Het team van Scott toonde aan dat ze een subcutane injectie konden toedienen die gedurende meer dan een maand langzaam nanomaterialen op een gecontroleerde manier aan cellen in lymfeklieren afleverde.
Scott zei dat het systeem naast micellen ook voor andere nanostructuren kan worden gebruikt. Bijvoorbeeld, het systeem kan vesikelvormige nanodeeltjes bevatten, zoals liposomen of polyersomen, die medicijnen hebben, eiwitten, of antilichamen die erin vastzitten. Verschillende blaasjes kunnen verschillende medicijnen dragen en ze met verschillende snelheden in het lichaam afgeven.
"Vervolgens zoeken we naar manieren om het systeem af te stemmen op de behoeften van specifieke ziekten en therapieën, " zei Scott. "We werken momenteel aan het vinden van manieren om chemotherapeutica en vaccins te leveren. Chemotherapie vereist meestal de toediening van meerdere toxische geneesmiddelen in hoge concentraties, en we zouden al deze medicijnen in één injectie kunnen afleveren in veel lagere doseringen. Voor immunisatie, deze injecteerbare hydrogels zouden kunnen worden toegediend als standaardvaccins, maar stimuleren specifieke cellen van het immuunsysteem langer, gecontroleerde perioden en mogelijk de noodzaak van boosters vermijden."
 Chemici laten zien hoe vooringenomenheid kan opduiken in de resultaten van machine learning-algoritmen
Chemici laten zien hoe vooringenomenheid kan opduiken in de resultaten van machine learning-algoritmen Nieuwe productietechniek voor hoogwaardig polymeer kan zorgen voor betere kogelvrije vesten
Nieuwe productietechniek voor hoogwaardig polymeer kan zorgen voor betere kogelvrije vesten Hoe de aanwezigheid van insecticiden in groenten en fruit te detecteren
Hoe de aanwezigheid van insecticiden in groenten en fruit te detecteren Hoe het aantal elektronen te vinden
Hoe het aantal elektronen te vinden Doorbraak bereikt bij het verbeteren van de ionische geleidbaarheid van brandstofcelmaterialen
Doorbraak bereikt bij het verbeteren van de ionische geleidbaarheid van brandstofcelmaterialen
 Wetenschappers proberen wolken helderder te maken om het Great Barrier Reef te beschermen
Wetenschappers proberen wolken helderder te maken om het Great Barrier Reef te beschermen Om klimaatverandering tegen te gaan, we moeten Amerikaanse bossen beschermen en uitbreiden
Om klimaatverandering tegen te gaan, we moeten Amerikaanse bossen beschermen en uitbreiden De juiste boodschap overbrengen over op de natuur gebaseerde oplossingen voor klimaatverandering
De juiste boodschap overbrengen over op de natuur gebaseerde oplossingen voor klimaatverandering Nieuw onderzoek verklaart waarom orkaan Harvey net voor de aanlanding heviger werd
Nieuw onderzoek verklaart waarom orkaan Harvey net voor de aanlanding heviger werd Onderzoek toont de prevalentie van microplastics in het zeewater van de Golf aan
Onderzoek toont de prevalentie van microplastics in het zeewater van de Golf aan
Hoofdlijnen
- Verschillen in mannelijke en vrouwelijke chromosomen
- Voedingsvormen van bacteriën
- Is het waar dat als je drie weken iets doet, het een gewoonte wordt?
- Biologen op het spoor van hersenetende amoeben
- Onderzoekers verkrijgen gegevens over de ontwikkeling van kippenembryo's
- Eiwit beëindigt opzettelijk de eigen synthese door de synthesemachinerie te destabiliseren - het ribosoom
- Een botanisch mysterie opgelost door fylogenetische tests
- Genetische modificatie: definitie, soorten, proces, voorbeelden
- Langstlevende dolfijn in gevangenschap sterft in aquarium Japan
- Wetenschappers creëren sneller, gevoeliger fotodetector door grafeen te misleiden

- Het minuscule modelleren:ontwerp met hoge resolutie van biomoleculen op nanoschaal
- Met een catch-and-release-proces, onderzoekers bevorderen grafeenelektronica

- De ontvlambaarheid van epoxyhars in bedwang houden

- Grafeencoating kan branden in lithiumbatterijen helpen voorkomen
 De rol van kelpbossen bij het verminderen van de klimaatverandering wordt bedreigd
De rol van kelpbossen bij het verminderen van de klimaatverandering wordt bedreigd De vroegste boeren van Scandinavië wisselden terminologie uit met Indo-Europeanen
De vroegste boeren van Scandinavië wisselden terminologie uit met Indo-Europeanen NASA vangt de stervende overblijfselen van tropische cycloon 12P
NASA vangt de stervende overblijfselen van tropische cycloon 12P Door het dunne-film glas, onderzoekers ontdekken een nieuwe vloeibare fase
Door het dunne-film glas, onderzoekers ontdekken een nieuwe vloeibare fase Met welke milieuproblemen wordt de volgende generatie geconfronteerd?
Met welke milieuproblemen wordt de volgende generatie geconfronteerd?  Uitlijnen van de primaire spiegelsegmenten van NASA's James Webb Space Telescope met licht
Uitlijnen van de primaire spiegelsegmenten van NASA's James Webb Space Telescope met licht Studie onderzoekt oorzaken van aardbevingen die diep onder het aardoppervlak ontstaan
Studie onderzoekt oorzaken van aardbevingen die diep onder het aardoppervlak ontstaan Algoritmen voor online winkelen werken samen om de prijzen hoog te houden
Algoritmen voor online winkelen werken samen om de prijzen hoog te houden
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

