
Wetenschap
Moleculaire dansbewegingen in slow motion vangen door witte ruis toe te voegen
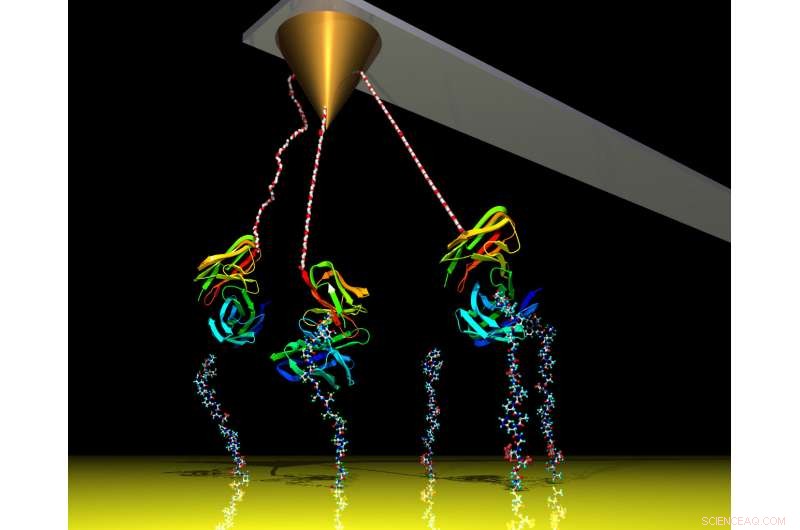
Een cantilever meet atomaire krachten afkomstig van eiwitten die interageren onder een atomaire krachtmicroscoop. Georgia Tech-ingenieurs hebben de gevoeligheid van het apparaat aanzienlijk verbeterd door elektronische witte ruis toe te voegen, waardoor het apparaat interacties van verder weg kan meten, waardoor het aanraken van biomoleculen wordt vermeden. Krediet:Georgia Tech / Haider, Pottenbakker
In extreme slowmotion, een medicijnmolecuul dat een celreceptor binnengaat, lijkt een beetje op een Sojoez-ruimtecapsule die aanmeert in het internationale ruimtestation. Het zou hier remmen, boost daar; draaien, vertalen en dan met een lichte schok, op zijn plaats vergrendelen.
Live, grote moleculen interageren met een snelheid van nanoseconden, praktisch ogenblikkelijk, waardoor ze bijna niet te zien zijn. Maar wetenschappers zijn een stap dichter bij het kunnen observeren van hun bewegingen - stuk voor stuk - dankzij de nieuwe fijnafstemming van een instrument op atomaire schaal door ingenieurs van het Georgia Institute of Technology.
De vooruitgang zou onderzoekers op een dag kunnen helpen erachter te komen waarom sommige medicijnen goed werken en andere minder, en meet details over de werking van het leven bij de wortel.
Atoomkrachten duidelijk gezien
De verbetering werkt door elektronische witte ruis zorgvuldig toe te voegen aan een sensorsonde in een atomic force microscope (AFM), die al gevoelig genoeg is om krachten te detecteren die worden uitgeoefend door op elkaar inwerkende moleculen, zoals eiwitreceptoren en vitamines. Maar zelfs met die capaciteiten op nanometerschaal, op een lichte maar belangrijke manier, AFM kan een bot instrument zijn.
"Er is een onvermogen van de sonde om het diepste deel van de interactie te bemonsteren, " zei onderzoeker Todd Sulchek, een universitair hoofddocent aan de Georgia Tech's School of Mechanical Engineering. "Je ziet hoe deze moleculen aan elkaar zijn gebonden of ongebonden. Het was zwart of wit, maar nu slagen we erin om verschillende grijstinten te krijgen."
Sulchek en afgestudeerde onderzoekers Ahmad Haider en Daniel Potter publiceerden de resultaten van hun technische oplossing in het tijdschrift the Proceedings van de National Academy of Sciences Vroege editie in de week van 21 november, 2016. Hun onderzoek werd gefinancierd door de National Science Foundation.
Kegel wiebelen een cantilever
Moleculen hebben trekstralen, zij het zwakke. Ze trekken aan elkaar met een reeks zwakke krachten, zoals van der Waals interacties, meestal gegenereerd hoewel negatieve of positieve polariteiten zich rond de moleculen verspreiden.

Door de contra-intuïtieve zet van het toevoegen van elektronische witte ruis, Daniel Potter (links) en Ahmad Raider (rechts) hebben de precisie van atoomkrachtmicroscopie aanzienlijk verhoogd om de wanden van energiebronnen te meten tijdens moleculaire interacties. Hun vooruitgang kan biotech-onderzoekers helpen om fijne details van biomoleculaire interacties te observeren. Krediet:Georgia Tech / Rob Felt
Atoomkrachtmicroscopen meten de aantrekkende energieën door een kegelvormige sonde op nanoschaal dicht bij de moleculen te steken om de krachten te voelen terwijl ze op elkaar inwerken. De kegel is bevestigd aan een cantilever, een flexibele kleine stok, en laat het wiebelen, terwijl de atoomkrachten de kegel op deze manier of dat trekken.
De cantilever brengt het trillen over in de microscoop, wat het in een bruikbaar signaal verandert, net zoals de naald van een draaitafel trillingen van een plaat overbrengt om in geluid te worden omgezet. Het resulterende signaal illustreert wat een energiebron wordt genoemd. De bovenkant van de put is het punt waar de adhesieve krachten gaan werken, en de onderkant is een punt over waar de moleculen elkaar ontmoeten.
Goed in de energie vallen
Maar als de krachten aan de kegel en de moleculen trekken, observeert het dichter bij elkaar, op een gegeven moment, ze rukken eigenlijk samen, het voorkomen van een gedetailleerde meting van de energiegradiënt. Als resultaat, als de kegel de op elkaar inwerkende moleculen nadert, onderzoekers zien de top van de energiebron en het einde van de interactie, maar de details van de muren van de put, vooral diep daar waar de moleculen het nauwst op elkaar inwerken, hen steevast ontwijken.
"De manier waarop we er omheen kwamen was, we hebben gewoon wat elektronische ruis op een goed gedefinieerde manier toegevoegd, en waardoor de sonde de interactie kon voelen toen hij nog relatief ver weg was van het oppervlak van de moleculen, " zei Sulchek. De elektronische vibratie, zogenaamde verbeterde stochastische fluctuatie, verminderde ook het effect van de adhesiekrachten die anders de cantilever en de moleculen samen zouden hebben gegrepen.
"Wat ik netjes vind, is dat het contra-intuïtief is, omdat u gewoonlijk ruis uit uw systeem probeert te elimineren om nauwkeurigere metingen te krijgen, maar we voegen ruis toe, " zei Sulchek. De verbetering omzeilt mogelijke vooroordelen die worden veroorzaakt door de toevoeging van ruis door onderzoekers in staat te stellen meer en langere monsters te nemen, het effectief annuleren van de effecten van de ruis in de algemene gegevens.
Het toevoegen van wat ruis klinkt misschien eenvoudig, maar het kostte Haider en Potter ruim twee jaar om erachter te komen hoe het kon werken en om vervelende aanpassingen aan de instrumentatie aan te brengen.
Bacteriële bankschroef grip ballet
De onderzoekers gebruikten interacties tussen de cantilever en een materiaal genaamd mica om de ontwikkeling van de verbetering te voltooien. Mica heeft een voorspelbare vorm en lading, goed voor benchmarking - het is erg soepel. "Mica is atomair vlak, "Zei Sulchek. "Dat en grafiet zijn ongeveer de twee vlakste oppervlakken die je kunt bouwen."

Todd Sulchek leidde de technische inspanningen om de atoomkrachtmicroscopie te verbeteren door elektronische witte ruis toe te voegen aan de cantilever die moleculaire interacties detecteert. De vooruitgang duurde twee jaar om te bereiken. Krediet:Georgia Tech / Rob Felt
Nutsvoorzieningen, Het team van Sulchek test de verbeterde cantilever in een biologisch scenario - een eiwit van Streptomyces avidinii-bacteriën, die met wraak de vitamine biotine opeet. het eiwit, streptavidine, bindt zich zo stevig aan biotine, dat onderzoekers het vaak gebruiken om moleculaire adhesie te bestuderen.
"Het is de sterkste bio-interactie die de wetenschap kent, "Zei Sulchek. Streptavidin's bankschroefgreep zorgt voor een goed gestandaardiseerde testcase voor het nieuw verfijnde apparaat. "Er gaat een klep open en de biotine past erin als een handschoen, "Zei Sulchek. "We willen zien of we kunnen kijken hoe dat gebeurt en zijn energie goed meten."
Kanker, AIDS, auto immuunziekte
Dat brengt Sulchek dichter bij zijn droom van een instrument om experimenteel biomoleculair onderzoek te stimuleren, en mogelijk leiden tot inzichten die nuttig zijn voor de geneeskunde. "Ik wil een tool hebben om deze tussenstappen te visualiseren, " zei hij. "Ik wil een hulpmiddel om die kortstondige staten te zien."
Onderzoekers zouden zo'n verbeterd hulpmiddel kunnen gebruiken om auto-immuunziekten beter te begrijpen, immunotherapie om kanker te behandelen of het vermogen van HIV om een antilichaamafweer te dwarsbomen.
"Veel antilichamen hebben twee bindingsplaatsen, en daar is een reden voor, maar we begrijpen nog niet waarom, "Zei Sulchek. "We weten dat je niet wilt dat antilichamen te sterk op elkaar inwerken." het kan leiden tot auto-immuunziekten.
"Er zijn veel therapieën waarbij antilichamen betrokken zijn, en sommige werken goed; anderen werken niet goed, " zei Sulchek. Antilichamen hechten mogelijk niet optimaal aan HIV, bijvoorbeeld, omdat ze het moeilijk hebben om rond het virus te wikkelen.
Het vastleggen van de onhandige actie in extreme slow motion kan op een dag biomedische onderzoekers helpen een effectiever antilichaam te ontwerpen om het virus verder te verijdelen.
 Handdesinfecterend middel opnieuw ontwerpen en doneren 7, 000 gallons om COVID-19 te bestrijden
Handdesinfecterend middel opnieuw ontwerpen en doneren 7, 000 gallons om COVID-19 te bestrijden Aluminiumpoeder maken
Aluminiumpoeder maken Elektriciteit gebruiken om verontreinigende stoffen die overblijven na afvalwaterzuivering af te breken
Elektriciteit gebruiken om verontreinigende stoffen die overblijven na afvalwaterzuivering af te breken Onderzoekers vinden een manier om kleine cyclodextrines te synthetiseren
Onderzoekers vinden een manier om kleine cyclodextrines te synthetiseren Goedkoop organisch materiaal geeft veilige batterijen een langere levensduur
Goedkoop organisch materiaal geeft veilige batterijen een langere levensduur
 Onderzoekers werken aan het verbeteren van de gezondheid van de bergachtige zijrivieren van de San Diego Rivers
Onderzoekers werken aan het verbeteren van de gezondheid van de bergachtige zijrivieren van de San Diego Rivers Toekomst van technologie voor planeetkoeling:studie creëert routekaart voor onderzoek naar geo-engineering
Toekomst van technologie voor planeetkoeling:studie creëert routekaart voor onderzoek naar geo-engineering Bloeiende planten met stekelige zaaddozen
Bloeiende planten met stekelige zaaddozen  Het gesprek tussen plant en bodem
Het gesprek tussen plant en bodem Een oceaan 13 miljoen jaar in de maak
Een oceaan 13 miljoen jaar in de maak
Hoofdlijnen
- Transformatief onderzoek onrealistisch om te voorspellen, wetenschappers vertellen subsidieverstrekkers
- Namen van de enzymen in de mond & slokdarm
- Onderzoeker bestudeert vampier zilverprik
- Waarom heeft een regenworm een gesloten bloedsomloop?
- Een grote stap in de richting van het verminderen van streptokokken bij op de boerderij gekweekte tilapia
- Zich in het volle zicht verbergen - Ontdekking roept vragen op over de schaal van de over het hoofd geziene biodiversiteit
- Onderzoekers identificeren moleculaire motor die chromosomen transformeert
- Cyanobacteriële studies onderzoeken de celstructuur tijdens stikstofgebrek
- Wat zijn twee typen endoplasmatisch reticulum?
- Hondsdolheidtruc kan de ziekte van Parkinson helpen behandelen
- Wetenschappers leggen uit waarom sommige moleculen zichzelf spontaan rangschikken in vijf plakjes taart op nanoschaal
- Materialen produceren om de schaallimiet voor elektronica te doorbreken

- Berkeley-onderzoekers verlichten witte OLED's

- Wetenschappers komen met nieuw proces dat HD-tv kan verbeteren

 Astronomen identificeren tientallen nieuwe OB-type sterren in de stellaire associatie Cygnus OB2
Astronomen identificeren tientallen nieuwe OB-type sterren in de stellaire associatie Cygnus OB2 Humanitair werk op de kaart zetten
Humanitair werk op de kaart zetten Leiden door COVID:de zwaarst getroffenen helpen
Leiden door COVID:de zwaarst getroffenen helpen Open-source systeembeveiliging software-updates afgestudeerden om toonaangevende cloudservices te beschermen
Open-source systeembeveiliging software-updates afgestudeerden om toonaangevende cloudservices te beschermen Hoe houden ze de deeltjes in de LHC bij?
Hoe houden ze de deeltjes in de LHC bij?  Tieners besteden tegenwoordig meer tijd aan digitale media, minder tijd lezen
Tieners besteden tegenwoordig meer tijd aan digitale media, minder tijd lezen Zeldzame Gabon-grafgrot onthult aanwijzingen voor de Afrikaanse geschiedenis
Zeldzame Gabon-grafgrot onthult aanwijzingen voor de Afrikaanse geschiedenis Astronomen ontdekken radio-emissie van een symbiotische röntgendubbelster
Astronomen ontdekken radio-emissie van een symbiotische röntgendubbelster
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

