
Wetenschap
Nanodeeltjes met eiwitpaspoorten ontwijken immuunsysteem, meer medicijnen afleveren aan tumoren
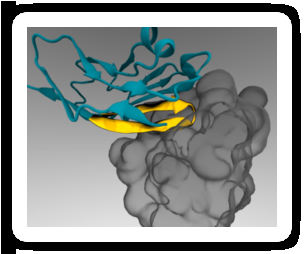
Een minimaal peptide 'paspoort' (geel) kan aan therapeutische nanodeeltjes worden bevestigd, zodat het zich bindt aan een immuuncelreceptor (grijs) en verzwelging voorkomt. Krediet:Diego Pantano
Wetenschappers hebben een manier gevonden om nanodeeltjes met tumorbestrijdende medicijnen langs cellen van het immuunsysteem te sluipen, die normaal gesproken de deeltjes zouden verzwelgen, voorkomen dat ze hun doel bereiken. De techniek maakt gebruik van het feit dat alle cellen in het menselijk lichaam een eiwit op hun vliezen vertonen dat als een specifiek 'paspoort' fungeert om immuuncellen te instrueren hen niet aan te vallen. Door een klein stukje van dit eiwit aan nanodeeltjes te hechten, wetenschappers waren in staat om immuuncellen in muizen voor de gek te houden door de deeltjes te herkennen als 'zelf' in plaats van vreemd, waardoor de hoeveelheid medicatie die aan tumoren wordt toegediend toeneemt.
Kanker nanotechnologie
De huidige benaderingen van chemotherapie laten patiënten met ernstige bijwerkingen achter, omdat geneesmiddelen tegen kanker die bedoeld zijn om tumoren te vernietigen, onbedoeld gezonde cellen in het lichaam doden. Maar wetenschappers hebben onlangs nanodeeltjes ontwikkeld die giftige medicijnen rechtstreeks naar tumoren kunnen transporteren terwijl ze gezond weefsel sparen. Door hun kleine formaat, nanodeeltjes ontsnappen uit lekkende bloedvaten die kenmerkend zijn voor tumoren en hopen zich op in het kankerweefsel. Tumorcellen nemen de deeltjes op die hun giftige inhoud eenmaal binnen afgeven. Dit gelokaliseerde toedieningssysteem stelt artsen in staat om patiënten hogere doses medicijnen te geven dan normaal zou worden getolereerd.
Eerdere pogingen zijn gedaan om aanvallen door het immuunsysteem af te weren door nanodeeltjes dicht te coaten met polyethyleenglycol (PEG) "borstels" die fysiek de adhesie blokkeren van eiwitten die zich normaal op vreemde lichamen afzetten om macrofagen aan te trekken. Terwijl deze borstels het begin van de immuunrespons vertragen, ze voorkomen het niet.
De inspiratie voor het doorbraakwerk van Discher dateert van dertien jaar toen een groep onderzoekers met genetisch gemanipuleerde muizen aantoonde dat een eiwit genaamd CD47 - dat in de celmembranen van bijna alle zoogdieren wordt aangetroffen - interageert met een receptor op macrofagen genaamd SIRPa, en, daarbij, geeft aan dat de cel inheems is en niet mag worden vernietigd. De bevindingen draaiden om het verwijderen van muis CD47 en riepen veel vragen op, inclusief hoe dergelijke muizen overleven en of er relevantie was voor mensen.
Discher, die op het moment van de ontdekking nanodeeltjes ontwikkelde die zichzelf in verschillende vormen assembleren, besefte dat het CD47-SIRPa-mechanisme voor zelfherkenning, in principe, worden misbruikt om nanodeeltjes te helpen langs het immuunsysteem te sluipen. Maar het was ook duidelijk dat menselijke versies van gezuiverde eiwitten bestudeerd moesten worden voor elke vertaling naar de mens.
In 2008, Het laboratorium van Discher toonde aan dat menselijk CD47 op dezelfde manier werkt als muis-CD47 als een "marker van het zelf" via signalering via de SIRPa-receptor. Kort daarna, een groep onderzoekers heeft de gecombineerde structuur van menselijk CD47 en SIRPa in atomaire details opgehelderd. Het lab van Discher gebruikte deze informatie om computersimulaties uit te voeren en het kleinste deel van CD47 te identificeren dat nog aan SIRPa kon binden. Het resultaat was een kort peptide dat door het laboratorium van Discher chemisch werd gesynthetiseerd en vastgemaakt aan standaard nanodeeltjes.
"Het reduceren van CD47 tot een essentieel peptide was een belangrijke stap, " zei Discher. "Sequencing van duizenden menselijke genomen over de hele wereld heeft onlangs veel variaties in de sequenties van CD47 en SIRPa onthuld. We moesten een 'universeel' peptide ontwikkelen dat SIRPa zou kunnen binden en ondanks deze verschillen bij alle mensen zou kunnen functioneren."
Stealth nanodeeltjes vermijden immuunrespons
Om te testen of hun peptide nanodeeltjes kan helpen het immuunsysteem te ontwijken, Het team van Discher injecteerde zowel peptidegebonden nanodeeltjes als nanodeeltjes zonder CD47 in muizen. Beide soorten nanodeeltjes bevatten een fluorescerende kleurstof waarmee de wetenschappers de deeltjes konden volgen. In een artikel gepubliceerd op 22 februari, 2013 in Wetenschap , de onderzoekers meldden dat in slechts dertig minuten na injectie van de deeltjes, het bloed van de muizen bevatte vier keer zoveel nanodeeltjes met CD47-peptide als deeltjes zonder het peptide, wat suggereert dat CD47-gebonden deeltjes door macrofagen werden gezien als vergelijkbaar met cellen die in het lichaam thuishoorden.
Aangemoedigd door deze eerste resultaten, het team vulde vervolgens hun CD47-gebonden nanodeeltjes, evenals PEG-gecoate nanodeeltjes zonder CD47, met het antikankergeneesmiddel paclitaxel plus een tumor-targeting antilichaam. Het team injecteerde beide soorten nanodeeltjes en Cremophore - de standaarddrager voor paclitaxel - afzonderlijk in muizen met mensachtige tumoren. Na slechts één dag, de tumoren bij muizen die waren geïnjecteerd met CD47-gebonden nanodeeltjes waren 70% zo groot als die geïnjecteerd met de PEG-gecoate nanodeeltjes. Aanvullend, CD47-gebonden nanodeeltjes waren net zo goed of beter in het verkleinen van de tumoren als Cremophore zonder bijwerkingen te veroorzaken. Het team ging verder met het documenteren van de moleculaire veranderingen die optreden in macrofagen wanneer CD47 verzwelging remt, wat suggereert dat aanvullende medicijnen kunnen worden gebruikt om de klaring te remmen.
"Klinische proeven met nanodeeltjes om geneesmiddelen tegen kanker te leveren zijn momenteel aan de gang, maar klaring door het immuunsysteem blijft een belangrijke hindernis, " zei Karen Peterson, doctoraat, Senior Adviseur Extramurale Programma's bij NIBIB. "Dischers werk is een elegante benadering, die andere nanotherapeutica in staat zouden kunnen stellen om effectief te zijn in klinische onderzoeken door een moleculaire "authenticatie" te bieden die het lichaam niet als vreemd herkent."
Peterson merkte ook de combinatie van bio-engineering en computermodellering op die nodig was om het peptide te genereren; Het vermogen van Discher om eerst de functie van peptiden van verschillende grootte te testen via computersimulatie, en vervolgens een door de mens gemaakt peptide te produceren op basis van deze simulaties, waardoor hij een deel van het raadspel kon elimineren, tijd en geld besparen op de lange termijn.
Toekomstige toepassingen
Discher speculeert dat zijn CD47-peptide op dezelfde manier kan worden gebruikt om immuunklaring te voorkomen van virussen die worden gebruikt om genen voor gentherapiebehandeling af te leveren of om de biocompatibiliteit en duurzaamheid van grotere vreemde voorwerpen zoals pacemakers en implantaten te verbeteren. waarvan de onderdelen na verloop van tijd kunnen degraderen als gevolg van aanvallen van het immuunsysteem.
 Enzymboost kan de productie van biobrandstoffen en andere bioverwerkte materialen versnellen
Enzymboost kan de productie van biobrandstoffen en andere bioverwerkte materialen versnellen De toekomst van biobrandstoffen in het donker
De toekomst van biobrandstoffen in het donker Voordeel:Water—Onderzoekers lossen belangrijke vraag op over titaniumoxide, water interacties
Voordeel:Water—Onderzoekers lossen belangrijke vraag op over titaniumoxide, water interacties Lab stapt op het gas om de chemische productie te verbeteren
Lab stapt op het gas om de chemische productie te verbeteren Een eeuwenoud model voor het ontstaan van levens krijgt flinke onderbouwing
Een eeuwenoud model voor het ontstaan van levens krijgt flinke onderbouwing
 Als het om klimaatverandering gaat, Australische mijnbouwreuzen zijn medeplichtig aan de misdaad
Als het om klimaatverandering gaat, Australische mijnbouwreuzen zijn medeplichtig aan de misdaad Onderzoek naar de impact van klimaatverandering op snowpack
Onderzoek naar de impact van klimaatverandering op snowpack Zeewier Feiten voor Kids
Zeewier Feiten voor Kids Onderzoek onthult hoe fluitende doorn acaciaboom en patasaap lijken op de Truffula-boom en de Lorax
Onderzoek onthult hoe fluitende doorn acaciaboom en patasaap lijken op de Truffula-boom en de Lorax Inzichten in gedrag tijdens schoorsteenbrand Tops 2 kunnen evacuatieplanning verbeteren
Inzichten in gedrag tijdens schoorsteenbrand Tops 2 kunnen evacuatieplanning verbeteren
Hoofdlijnen
- Grootte is belangrijk - hoe trips hun partners kiezen
- Dino-dodende asteroïde versnelde evolutie van vogels
- Droogte geen dingo's achter het uitsterven van tijgers op het vasteland van Australië:studie
- In bijensterfte, fungiciden komen naar voren als onwaarschijnlijke schurk
- Hoe goed kennen mensen zichzelf eigenlijk?
- Mensen evolueren nog steeds - Heres the Evidence
- Bladcelstructuur
- Wormsoorten verloren 7, 000 genen na evolutie om zichzelf te bevruchten
- Honden en wolven delen parasieten
- Grafeenvellen vangen cellen efficiënt op
- Wetenschappers gebruiken scheikunde die de Nobelprijs heeft gewonnen voor doorbraak in schone energie

- Begrip van ladingsscheiding kan leiden tot goedkopere, efficiëntere organische zonnecellen
- Autokannibalistische materialen voeden zich met zichzelf om nieuwe nanostructuren te laten groeien

- Wat kan een grafeensandwich onthullen over eiwitten?

 De meeste volwassenen hebben nog nooit van TikTok gehoord. Dat is zo ontworpen
De meeste volwassenen hebben nog nooit van TikTok gehoord. Dat is zo ontworpen Eerste momentopname van exciton-polariton condensatieproces
Eerste momentopname van exciton-polariton condensatieproces DNA-nanorobot triggert gerichte therapeutische reacties
DNA-nanorobot triggert gerichte therapeutische reacties Studie legt uit hoe druppeltjes kunnen zweven op vloeibare oppervlakken
Studie legt uit hoe druppeltjes kunnen zweven op vloeibare oppervlakken Tropische regenwoudaanpassingen van planten en dieren
Tropische regenwoudaanpassingen van planten en dieren Slow boat naar China:vrachtschepen aangespoord om snelheid en vervuiling te verminderen
Slow boat naar China:vrachtschepen aangespoord om snelheid en vervuiling te verminderen Gegevensanalyse voor een veiliger luchtruim
Gegevensanalyse voor een veiliger luchtruim Oproep voor ingenieurs om op te treden tegen klimaatverandering
Oproep voor ingenieurs om op te treden tegen klimaatverandering
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | German | Dutch | Danish | Norway | Portuguese | Swedish |

-
Wetenschap © https://nl.scienceaq.com

