
Wetenschap
Voordeel:Water—Onderzoekers lossen belangrijke vraag op over titaniumoxide, water interacties
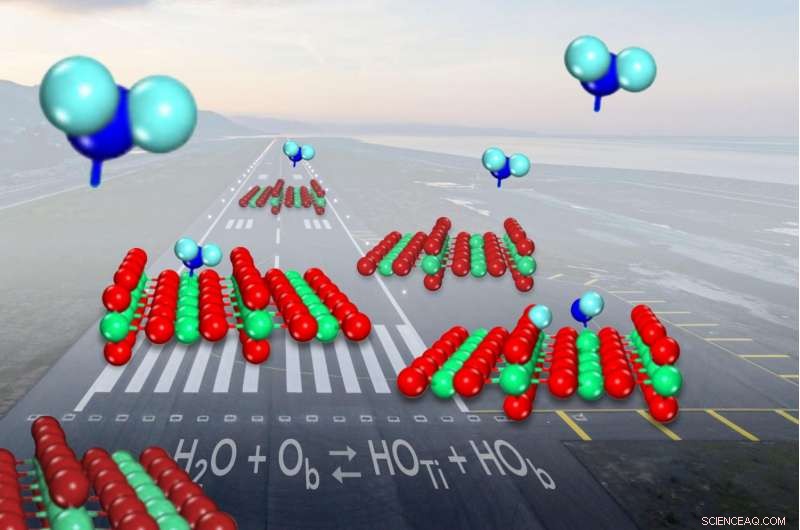
Wanneer water (weergegeven in blauw) binnenkomt voor een landing op de gemeenschappelijke katalysator titaniumoxide (weergegeven in rood en groen), het splitst zich iets minder dan de helft van de tijd in hydroxylen (op het linkeroppervlak). Krediet:Zdenek Dohnalek
Wanneer een watermolecuul binnenkomt voor een landing op de gemeenschappelijke katalysator titaniumoxide, het breekt soms en vormt een paar molecuulfragmenten die bekend staan als hydroxyls. Maar wetenschappers hadden niet kunnen aantonen hoe vaak het uiteenvallen gebeurde. Nutsvoorzieningen, onderzoekers hebben vastgesteld dat water slechts iets meer kans heeft om in één stuk te blijven omdat het zich aan het katalysatoroppervlak bindt dan dat het de hydroxylparen vormt.
Het resultaat - het voordeel van water is zo klein - zal sommige chemici misschien verbazen. Maar het begrijpen van dat kleine voordeel heeft een brede betekenis voor een verscheidenheid aan potentiële toepassingen in industrieën die titaniumdioxide gebruiken. Deze industrieën omvatten de productie van alternatieve brandstoffen, zonne-energie en voedselveiligheid, en zelfs zelfreinigende ramen. Het zal wetenschappers ook helpen beter te begrijpen hoe zuren zich gedragen en hun kennis over hoe moleculen splitsen vergroten.
"Hoe water bindt, was de grote vraag, " zei chemicus Zdenek Dohnalek van het Pacific Northwest National Laboratory van het Department of Energy. "Chemici hadden gemengde informatie van veel verschillende methoden, en theoretici hadden ook ideeën. Met behulp van een unieke combinatie van instrumenten, we hebben het eindelijk opgelost."
Het team rapporteerde het werk in de Proceedings van de National Academy of Sciences .
Land van mysterie
Hoewel veel industrieën titaniumoxide gebruiken om chemische reacties te versnellen, wetenschappers hebben niet al zijn geheimen onthuld. Een sleutelmysterie, onderzoekers hebben lang gedebatteerd, is de manier waarop water interageert met titaniumoxide. De interactie is op zichzelf al belangrijk om water te splitsen, maar het beïnvloedt ook het verloop van veel reacties in het algemeen.
Op het oppervlak van titaniumoxide, watermoleculen wisselen tussen intact zijn en splitsen in hydroxylen. Hoewel er veel verschillende manieren zijn om de verhouding van intact water tot hydroxylen op een bepaald moment te meten, wetenschappers zijn er al decennia niet in geslaagd om het vast te spijkeren.
Om het probleem te onderzoeken, PNNL-onderzoekers combineerden verschillende tools op een nieuwe manier. Ze stuurden waterstralen met verschillende snelheden op koud titaniumoxide, zittend onder een microscoop met een zeer hoge resolutie die bekend staat als een scanning tunneling-microscoop.
Met de microscoop konden ze de titanium- en zuurstofatomen van de katalysator visualiseren. De atomen verschijnen als heldere en donkere rijen, als een korenveld met hoge rijen koren afgewisseld met greppels, en individuele watermoleculen verschijnen als heldere vlekken die niet op één lijn liggen met de rijen.
Naast het bekijken van watermoleculen wanneer ze het oppervlak raken, het team simuleerde details van de atomen die tot in detail op elkaar inwerken op een krachtige computer. Door experimenten en simulaties te combineren, kon het team het al lang bestaande debat beslechten.
Onmiddellijke aantrekkingskracht
In de vorm van een V, een watermolecuul heeft een vetzuurstofatoom in het midden gebonden aan twee kleinere waterstofatomen aan weerszijden. Titaanoxide helpt de bindingen tussen de atomen te verbreken om een chemische reactie vooruit te helpen:de titaniumatomen vangen watermoleculen op, terwijl zuurstof in de buurt, ook een deel van het katalysatoroppervlak, trekt weg en vangt vervolgens een van de waterstofatomen op.
Wanneer dit gebeurt, twee hydroxylen worden gevormd, een van een zuurstof aan het oppervlak die combineert met de waterstof en de andere die overblijft van het watermolecuul.
De wetenschappers moesten weten hoe vaak de hydroxylen werden gevormd. Blijven watermoleculen grotendeels intact aan het oppervlak? Of worden ze meteen omgezet in hydroxylen? Hoe waarschijnlijk het is dat water intact blijft op titaniumoxide - en hoe gemakkelijk de hydroxylen zich omvormen tot water - vormt de basis voor andere chemische reacties.
Er achter komen, de chemici moesten technologieën ontwikkelen om te meten hoe vaak de hydroxylen op het oppervlak ontstonden. Met behulp van middelen ontwikkeld binnen EMSL, het Environmental Molecular Sciences Laboratory, een DOE Office of Science User Facility bij PNNL, ze schoten een straal watermoleculen op een titaniumoxide-oppervlak met lage energie - de straal schoot langzaam, en met veel energie - snel bewegend als uit een brandslang.
Ze eindigden met lichtpuntjes op het oppervlak, en hoe hoger de energie, hoe meer plekken. Maar de vlekken zagen er niet helder genoeg uit om beide hydroxylen te bevatten, zoals verwacht, dus voerden ze aanvullende experimenten uit om te bepalen wat de vlekken waren.
Spot op
Het team schoot water op het titaniumdioxide-oppervlak en bevroor het water vervolgens op zijn plaats. Daarna warmden ze langzaam alles op. Het verhogen van de temperatuur onthulde de vlekken - waarvan ze dachten dat het ten minste één hydroxyl was - die in watermoleculen veranderden. Dit betekende dat elke plek eigenlijk een paar hydroxylen moest zijn, omdat het bewijs aantoonde dat alle grondstoffen die nodig waren om een watermolecuul te maken daar aanwezig waren, en beide hydroxylen waren nodig.
Ze voerden verschillende andere experimenten uit om de temperatuur te bepalen waarbij een landend watermolecuul wordt omgezet in hydroxylparen en vice versa. Daaruit leerden ze dat water slechts iets stabieler is dan de hydroxylparen aan het oppervlak - 10 procent meer, als we uitgaan van de hoeveelheid energie die nodig is om ze te verstoren.
De waterlandingen simuleren op een krachtige computer, ook bij EMSL, de onderzoekers ontdekten dat de enige watermoleculen die aan de katalysator bleven kleven degene waren die in een figuurlijke sloot in een maïsveld belandden, waar de zuurstof van het water tegenover een titaniumatoom in de sloot stond.
Als het water met precies de juiste snelheid binnenkwam, het water heroriënteerde en dook een van zijn waterstofatomen naar een nabijgelegen zuurstof, het vormen van de hydroxylparen die in de experimenten werden gezien. Als niet, het watermolecuul is net teruggekaatst.
"We ontdekten dat elektrostatica - dezelfde statische elektriciteit die vonken maakt als je met je voeten over het tapijt wrijft - hielp de watermoleculen naar het oppervlak te sturen, " zei theoretisch chemicus en coauteur Roger Rousseau.
Al deze details zullen onderzoekers helpen katalyse beter te begrijpen en ons begrip van chemische reacties te verbeteren. In aanvulling, de resultaten onthullen een waarde die wetenschappers lang hebben geprobeerd vast te stellen - hoe gemakkelijk of moeilijk het voor water is om waterstof op titaniumoxide te verliezen.
 Melkzuurbacteriën kunnen de houdbaarheid van voedingsmiddelen verlengen
Melkzuurbacteriën kunnen de houdbaarheid van voedingsmiddelen verlengen Nieuwe technologie kan wetshandhavers helpen kleinere hoeveelheden fentanyl met een hogere mate van nauwkeurigheid te detecteren
Nieuwe technologie kan wetshandhavers helpen kleinere hoeveelheden fentanyl met een hogere mate van nauwkeurigheid te detecteren Zou de aarde van gisteren aanwijzingen kunnen bevatten voor het maken van de medicijnen van morgen?
Zou de aarde van gisteren aanwijzingen kunnen bevatten voor het maken van de medicijnen van morgen? Duurzamere omzetting van aminozuren met licht in plaats van met warmte
Duurzamere omzetting van aminozuren met licht in plaats van met warmte Hoe de evenwichtige chemische reactie voor het roesten van ijzer te schrijven
Hoe de evenwichtige chemische reactie voor het roesten van ijzer te schrijven
 Kunnen we de mariene chemie aanpassen om klimaatverandering tegen te gaan?
Kunnen we de mariene chemie aanpassen om klimaatverandering tegen te gaan? Landbouw in Europa neemt af naarmate Aziatische productie groeit:VN, OESO
Landbouw in Europa neemt af naarmate Aziatische productie groeit:VN, OESO Mensen beschouwen de gezondheidsrisico's van de binnenlucht als groter dan wat wordt gesuggereerd door onderzoeksgegevens
Mensen beschouwen de gezondheidsrisico's van de binnenlucht als groter dan wat wordt gesuggereerd door onderzoeksgegevens Hoe doet asperges de geur van urine?
Hoe doet asperges de geur van urine?  Studie bevestigt bliksem krachtiger over oceaan dan over land
Studie bevestigt bliksem krachtiger over oceaan dan over land
Hoofdlijnen
- Wat veroorzaakt het uitsterven van planten en dieren?
- Lantaarnvissen onthullen hoe de opwarming van de oceaan de schemerzone beïnvloedt
- Plasticity Cell Definition
- Projectideeën om het menselijke spijsverteringsstelsel te laten zien op de middelbare school voor studenten
- Hoe het Human Microbiome-project werkt
- Paranoia zal vernietigen:wanneer overschrijdt gezonde angst de grens in paranoia?
- Welke landen hebben de kleinste persoonlijke ruimte?
- Maak een lijst van de soorten informatie die gevonden kan worden door de sequentie van een DNA-molecuul te kennen Molecule
- DNA-modellen maken met behulp van papier
- Nieuwe ontwikkeling in contactlenzen voor rood-groene kleurenblindheid met eenvoudige kleurstof

- Nieuwe 3D-printmethode kan materiaal achter vitale medische isotoop transformeren

- De kracht van elektriciteitproducerende bacteriën benutten voor programmeerbare biohybriden

- Waterstof in hybride perovskieten is minder onschuldig dan het lijkt
- Vrijgave van medicijnen uit een supramoleculaire kooi

 Google investeert miljarden in Amerikaanse activiteiten
Google investeert miljarden in Amerikaanse activiteiten Google zet stappen om gendervooroordelen in vertaling te beteugelen
Google zet stappen om gendervooroordelen in vertaling te beteugelen Naarmate de zomers warmer worden, meer regen is misschien niet beter dan minder
Naarmate de zomers warmer worden, meer regen is misschien niet beter dan minder De COVID-19-lockdown in Kenia dwingt mensen om moeilijke beslissingen te nemen over voedsel en huishoudelijke energie
De COVID-19-lockdown in Kenia dwingt mensen om moeilijke beslissingen te nemen over voedsel en huishoudelijke energie Goud van Dirt
Goud van Dirt Past één maat allemaal? Een nieuw model voor organische halfgeleiders
Past één maat allemaal? Een nieuw model voor organische halfgeleiders De giftige lucht in de steden van Groot-Brittannië vereist dringende actie - geen juridische vertragingen
De giftige lucht in de steden van Groot-Brittannië vereist dringende actie - geen juridische vertragingen Hoe Youngs Modulus
Hoe Youngs Modulus
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- Italian | Spanish | Swedish | Dutch | Danish | French | Portuguese | German | Norway |

-
Wetenschap © https://nl.scienceaq.com

