Wetenschap
Single-shot 3D wide-field fluorescentiebeeldvorming met een computationele miniatuurmesoscoop
Online dekking - een Computational Miniature Mesoscope (CM2). Afbeelding tegoed:Xue et al., wetenschappelijke vooruitgang, doi:10.1126/sciadv.abb7508
De online functie omslagfoto op wetenschappelijke vooruitgang toont deze week fluorescentiebeeldvorming met een computationele miniatuurmesoscoop (CM 2 ). De techniek van fluorescentiebeeldvorming is een essentieel hulpmiddel voor biologen en neurowetenschappers; echter, conventionele microscopen en geminiaturiseerde microscopen (miniscopen) worden beperkt door een product met beperkte ruimte-bandbreedte - een meting van de informatiecapaciteit van een optisch systeem, ondiepe scherptediepte en een onvermogen om driedimensionale (3-D) gedistribueerde emitters op te lossen. Om bestaande limieten te overwinnen, Yujia Xue en een team van onderzoekers in elektrotechniek en computertechniek, biologie, neurofotonica en biomedische technologie aan de Boston University, ONS., ontwikkelde een lichte en compacte mesoscoop die bekend staat als de computationele miniatuurmesoscoop (CM 2 ).
Het nieuwe platform integreerde een microlens voor beeldvorming en een LED-array voor excitatie binnen dezelfde opstelling. Het apparaat voerde single-shot 3D-beeldvorming uit en zorgde voor een 10-voudige gezichtsveldversterking en een 100-voudige scherptediepteverbetering, vergeleken met bestaande miniscopen. Xue et al. testte het apparaat met fluorescerende kralen en vezels naast fantoomexperimenten om de effecten van bulkverstrooiing en achtergrondfluorescentie te meten. Het team bespreekt de bruikbaarheid van deze mesoscoop voor brede toepassingen in de biogeneeskunde en 3D neurale opname.
Vooruitgang in fluorescentiemicroscopie
Fluorescentiemicroscopie is een sleuteltechniek in de fundamentele biologie en systeemneurowetenschappen. Recente technologische ontwikkelingen zijn gericht op het overwinnen van schaalbarrières om individuele neuronen van slechts enkele micron groot te onderzoeken. Bijvoorbeeld, macroscopen, mesolens-microscopen en twee-fotonenmicroscopen beginnen deze schaal te overbruggen; echter, de ontwikkeling van dergelijke beeldvormingssystemen wordt beperkt door schaalafhankelijke geometrische aberraties van optische elementen. Het bereikbare gezichtsveld (FOV) wordt ook beperkt door de geringe scherptediepte van het systeem in veel bioimaging-toepassingen. Onderzoekers zijn ook gericht op het miniaturiseren van de technologie om in vivo beeldvorming mogelijk te maken bij dieren die zich vrij gedragen. Bijvoorbeeld, geminiaturiseerde microscopen die bekend staan als 'miniscopen' hebben ongekende toegang gekregen tot neurale signalen, hoewel de systemen beperkt blijven door hun optica, net als hun tegenhangers van fluorescentiemicroscopie. Xue et al. daarom introduceerde en demonstreerde een computationele miniatuurmicroscoop (CM 2 ) met grootschalige, 3D-fluorescentiemetingen op een compacte, lichtgewicht plateau.
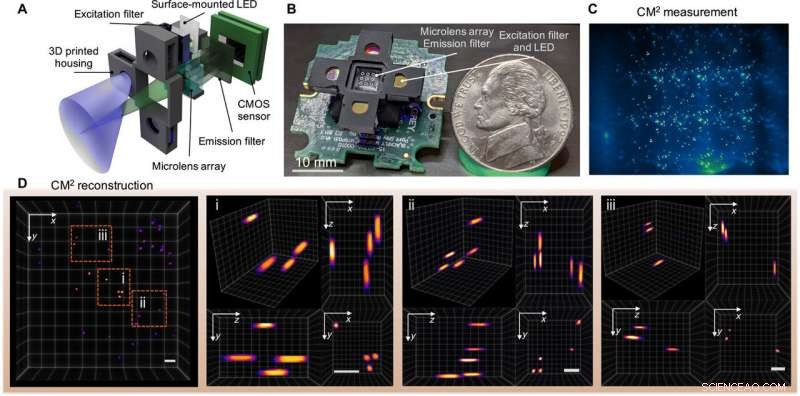
Single-shot 3D fluorescentie CM2. (A) De CM2 combineert een MLA-optiek en lichtemitterende diode (LED) array-excitatie in een compact en lichtgewicht platform. (B) Afbeelding van het CM2-prototype (de elektrische draden en de sensordriver zijn weggelaten). Fotocredit:Yujia Xue, De Universiteit van Boston. (C) CM2-meting op 100 m fluorescerende deeltjes gesuspendeerd in heldere hars. (D) geprojecteerde weergave van het CM2 gereconstrueerde volume (7,0 mm bij 7,3 mm bij 2,5 mm) en drie inzoomgebieden met orthogonale weergaven. Schaalbalken, 500 urn. CMOS, complementaire metaaloxide halfgeleider. Krediet:wetenschappelijke vooruitgang, doi:10.1126/sciadv.abb7508 
Het team gebruikte eenvoudige optica in de opstelling om ruimte-bandbreedte product (SBP) verbetering en 3D-beeldvormingsmogelijkheden te bereiken zonder de noodzaak van mechanisch scannen. De techniek omzeilde de fysieke grenzen van de geïntegreerde optica door gezamenlijk de hardware en het algoritme te ontwerpen. de CM 2 beeldvormingsmethode combineerde verschillende kenmerken van microscopische beeldvorming, zoals integrale beeldvorming, lichtveldmicroscopie en beeldvorming met gecodeerde apertuur. In zijn werkingsmechanisme, de microscoop verzamelde een enkele 2D-meting met behulp van een microlens-array (MLA) voor daaropvolgende computationele reconstructie van de 3D-fluorescentieverdeling.
de CM 2 gebruikte de microlens-array als het enige beeldelement en zorgde ervoor dat de opstelling de gezichtsveldlimieten (FOV) kon overwinnen die werden opgelegd door de objectieflens van conventionele microscopen. de CM 2 algoritme loste het 2-D-naar-3-D deconvolutieprobleem op om diepte-opgeloste reconstructies te bieden. Xue et al. legde het principe van de CM . uit 2 single-shot 3D-beeldvorming door een analogie te trekken met frequency division multiplexing (FDM). Het team kwantificeerde vervolgens de haalbare resolutie van de CM 2 door de 3D-modulatieoverdrachtsfunctie (MTF) van het systeem te berekenen en de laterale resolutie te analyseren.
Karakterisering van het beeldvormingsprincipe van de CM2, verschuivingsvariantie, en resolutie. (A) De CM2 produceert axiaal variërende array-PSF's om optische secties te bereiken. De axiale afschuiving in de zijhaarden wordt goed gekarakteriseerd door het geometrische model dat in de studie wordt gepresenteerd. De PCC van de axiaal gescande PSF's kwantificeert de verwachte axiale resolutie. EM, uitstoot. (B) De 3D MTF (weergegeven in logschaal) laat zien dat de CM2 uitgebreide axiale frequentie-informatie vastlegt en de SBP van het systeem vergroot. De ondersteuning van de experimentele MTF komt overeen met de theorie (in gestippelde curve). De hoek van elke gekantelde "band" in de MTF wordt bepaald door de hoeklocatie van de corresponderende microlens αMLA (in stippellijn). (C) De variantie van de laterale verschuiving wordt gekenmerkt door de PCC van de lateraal gescande PSF's. De PSF in de centrale FOV (gemarkeerd door oranje grenslijnen) bevat 3 × 3 foci; de PSF in de buitenste FOV (gemarkeerd door blauwe grenslijnen) bevat 2 × 3 of 3 × 2 foci; de PSF in de hoek FOV (gemarkeerd door gele grenslijnen) bevat 2 × 2 foci. (D) De resolutie in verschillende regio's van de FOV wordt gekenmerkt door het reconstrueren van een pinhole-object van 5 μm met behulp van het shift-invariante model van de CM2. De laterale volledige breedte op half maximum (FWHM) is consequent lager dan 7 m. De axiale FWHM is ~ 139 m in de centrale FOV en degradeert tot ~ 172 en ~ 189 m in de buitenste en hoek FOV's, respectievelijk. (E) Geometrie voor het afbeelden van een gekanteld fluorescerend doelwit. (F) Ruwe CM2-meting. (G) MIP's van het gereconstrueerde volume (8,1 mm bij 5,5 mm bij 1,8 mm). De kenmerken van 7 μm (groep 6, element 2) kan worden opgelost zoals weergegeven in de ingezoomde xy-projectie. Het axiale snijvermogen wordt gekenmerkt door de xz-projectie, valideren van de functiegrootteafhankelijke axiale resolutie. Krediet:wetenschappelijke vooruitgang, doi:10.1126/sciadv.abb7508 
Xue et al. benaderde de beeldvorming van de CM 2 setup met behulp van een slice-wise shift-invariant model. Ze karakteriseerden de resolutie en laterale verschuivingsvariantie van de opstelling voorafgaand aan experimentele beeldvorming en beeldden een fluorescerend resolutiedoel af om de laterale resolutie van de CM te valideren 2 . Ze valideerden de waarnemingen met behulp van Zemax-gesimuleerde metingen om een goede overeenkomst tussen de simulaties en de experimenten te vinden. Met het nieuwe platform konden de wetenschappers fluorescerende emitters lokaliseren die over een groot volume waren verdeeld. Ze testten de prestaties van CM 2 op monsters met een kenmerkgrootte vergelijkbaar met een enkel neuron. Tijdens deze experimenten, de CM 2 algoritme was tolerant voor signaaldegradaties zoals verminderde signaal-ruisverhoudingen om hoogwaardige, reconstructie van het volledige gezichtsveld. Het team vergeleek de CM 2 reconstructie en een axiale stapel verkregen door een objectieflens om de nauwkeurigheid van single-shot lokalisatie van individuele deeltjes aan te tonen.
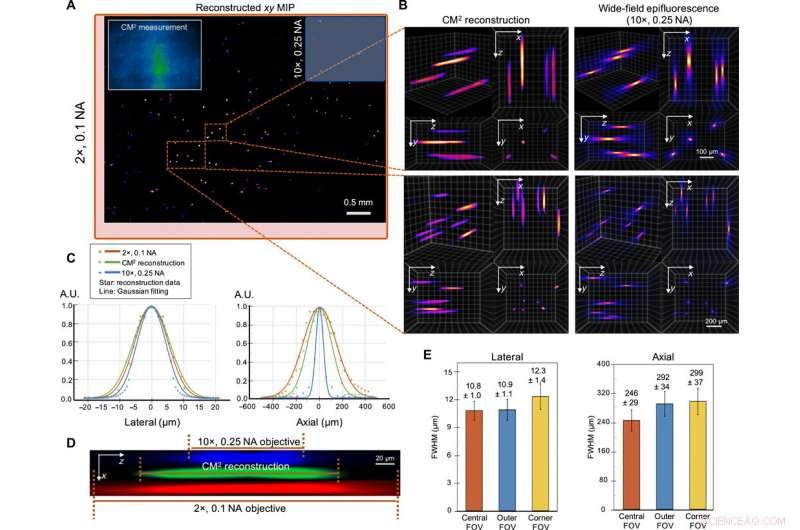
Single-shot 3D-beeldvorming van 10 μm fluorescerende deeltjes in een helder volume. (A) xy MIP van het gereconstrueerde volume van 5,7 mm bij 6,0 mm bij 1,0 mm. Inzet linksboven:Ruwe CM2-meting. Het gezichtsveld van de CM2 is vergelijkbaar met een 2× objectieflens (rood kader) en is ~25× breder dan de 10× objectieflens (blauw kader). (B) Zoom-in van de CM2 3D-reconstructie gebenchmarkt door de axiale stapel genomen door een 10×, 0.25 NA objectieflens. (C) Laterale en axiale doorsneden van het teruggewonnen deeltje van 10 m. Door te vergelijken met de metingen van de standaard wide-field fluorescentiemicroscopie, de CM2 herstelt getrouw het laterale profiel van het deeltje en bereikt single-shot dieptedoorsnede. AU, willekeurige eenheden. (D) xz dwarsdoorsnede van een gereconstrueerd fluorescerend deeltje, in vergelijking met de axiale stapel verkregen van de 2 × en 10 × objectieflenzen. (E) Om de ruimtelijke variaties van de reconstructie te karakteriseren, de statistieken van de laterale en axiale FWHM's van de gereconstrueerde deeltjes zijn uitgezet voor de centrale, buitenste, en hoek FOV. De laterale breedte verandert slechts in geringe mate (~0,9%) in de buitenste FOV, maar neemt toe in de hoek FOV (~13,9%). De axiale verlenging neemt af van ~ 246 m in het centrale gezichtsveld tot ~ 292 en ~ 299 m in de buitenste en hoekige FOV-regio's, respectievelijk. Krediet:wetenschappelijke vooruitgang, doi:10.1126/sciadv.abb7508
Experimenten met fluorescerende vezels op een gekromd oppervlak en met gecontroleerde verstrooiende fantomen.
De wetenschappers testten vervolgens het vermogen om complexe volumetrische fluorescerende monsters af te beelden op fluorescerende vezels verspreid over een 3D-geprint gebogen oppervlak, het oppervlakteprofiel van een muiscortex nabootsen, over een breed gezichtsveld en een uitgebreide diepte. Het algoritme heeft de in-focusstructuren nauwkeurig hersteld en opgelost voor het 3D-object, terwijl de meeste individuele vezels worden opgelost. Het team voerde verder experimenten uit op acht beeldvormende fantomen om de prestaties van CM . te testen 2 onder bulkverstrooiing en sterke achtergrondfluorescentie. Tijdens de experimenten, ze zaaiden alle fantomen met dezelfde concentratie van fluorescerende doeldeeltjes en schreven de verschillen in reconstructie toe aan bulkverstrooiing en achtergrondfluorescentie. Het team nam vervolgens fluorescerende deeltjes van 1,1 m op om onoplosbare fluorescerende bronnen na te bootsen die vaak worden gezien op biologische monsters; zoals neutropilen in de hersenen. Ze kwantificeerden het verstrooiingsniveau voor elk fantoom, voerde 3D-reconstructie uit voor elk verstrooiingsfantoom en voerde alle deconvoluties uit met dezelfde rekenkundige instelling. Het geschatte dieptebereik van de reconstructie varieerde met oppervlaktevariaties die in elk fantoom aanwezig waren.

Reconstructie van fluorescerende vezels. Het filmbestand visualiseert de volumetrische reconstructie van fluorescerende vezels op een gebogen oppervlak. Ter vergelijking, de dieptekaart geschat op basis van de focale stapel van een breedveld epi-fluorescentiemicroscoop met een 2×, 0,1 NA objectieflens wordt weergegeven. Krediet:wetenschappelijke vooruitgang, doi:10.1126/sciadv.abb7508
Op deze manier, Yujia Xue en collega's ontwikkelden een nieuw geminiaturiseerd fluorescentiebeeldvormingssysteem om single-shot mesoscopische 3D-beeldvorming mogelijk te maken. De computationele miniatuurmesoscoop (CM 2 ) methode geïntegreerde fluorescentiebeeldvorming en de excitatiemodules op hetzelfde compacte platform. Het team presenteerde de simulaties en experimenten om het werkingsmechanisme en de 3D-beeldvormingscapaciteit van de CM . vast te stellen 2 . Ze simuleerden hersenbrede beeldvorming van vasculaire netwerken en de primaire resultaten waren veelbelovend. de CM 2 prototype is nog niet vergelijkbaar met op het hoofd gemonteerde in vivo toepassingen (op diermodellen) in neurowetenschappelijke laboratoria, hoewel het team voor ogen heeft het apparaat te optimaliseren voor volledig corticale in vivo beeldvorming in vrij bewegende muizen. Het beeldvormingsapparaat kan verder worden verbeterd met verdere ontwikkelingen in hardware en algoritmen om nieuwe en opwindende mogelijkheden te openen binnen in vivo neurale opname en biomedische toepassingen.
© 2020 Wetenschap X Netwerk
 Nieuw slim polymeer gloeit helderder wanneer uitgerekt
Nieuw slim polymeer gloeit helderder wanneer uitgerekt Elektriciteit opwekken via vloeroppervlakken
Elektriciteit opwekken via vloeroppervlakken Zelfgemaakte lijm uit melk maken voor een wetenschappelijk project
Zelfgemaakte lijm uit melk maken voor een wetenschappelijk project Voors en tegens van natuurlijke suiker en kunstmatige zoetstoffen
Voors en tegens van natuurlijke suiker en kunstmatige zoetstoffen Een technologie voor drukloze sinterverbinding voor vermogenshalfgeleiders van de volgende generatie
Een technologie voor drukloze sinterverbinding voor vermogenshalfgeleiders van de volgende generatie
 Nieuwe online tool toont klimaatverandering in je achtertuin
Nieuwe online tool toont klimaatverandering in je achtertuin Op jacht naar vermist reddingsteam in door overstromingen getroffen Vietnam meer regen voorspelling
Op jacht naar vermist reddingsteam in door overstromingen getroffen Vietnam meer regen voorspelling Waarom de kleine boeren in Ghana niet enthousiast zijn over de laatste Groene Revolutie
Waarom de kleine boeren in Ghana niet enthousiast zijn over de laatste Groene Revolutie Verbruikt u wekelijks een creditcard ter waarde van plastic?
Verbruikt u wekelijks een creditcard ter waarde van plastic? Zou de neolithische revolutie het bewijs kunnen leveren van de beste manieren om ons aan te passen aan klimaatverandering?
Zou de neolithische revolutie het bewijs kunnen leveren van de beste manieren om ons aan te passen aan klimaatverandering?
Hoofdlijnen
- "What Does Heterozygous Mean?
- Continentale controles nodig om de strijd tegen boomziekten te handhaven
- Genotype & Phenotype Definitie
- Hoe ver reizen invasieve soorten?
- Waarom zetten we de radio zachter als we verdwaald waren?
- Wat is late telofase?
- Hoe SARS werkt
- Big data helpt onderzoekers in de strijd om plantenindringers onder controle te krijgen
- Onderzoeker onthult hoe kevers terugveren van bosbranden
 Maakt u zich geen zorgen over de asteroïde die zaterdag op aarde overgaat
Maakt u zich geen zorgen over de asteroïde die zaterdag op aarde overgaat Aanpassingen van apen voor de Jungle
Aanpassingen van apen voor de Jungle Wetenschappers ontwikkelen onzichtbare anti-namaaketiketten
Wetenschappers ontwikkelen onzichtbare anti-namaaketiketten Hoe hoog boven zeeniveau ben ik? stelt de verkeerde vraag
Hoe hoog boven zeeniveau ben ik? stelt de verkeerde vraag Spreken met neuronen:nieuwe nanogestructureerde neurale elektroden
Spreken met neuronen:nieuwe nanogestructureerde neurale elektroden Modellering van galactische uitstulpingen werpt licht op de evolutie van sterrenstelsels
Modellering van galactische uitstulpingen werpt licht op de evolutie van sterrenstelsels Wat is de pH van zout water?
Wat is de pH van zout water?  Onderzoekers onderzoeken wat robots overtuigend maakt voor mensen
Onderzoekers onderzoeken wat robots overtuigend maakt voor mensen
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Portuguese | Swedish | German | Dutch | Danish | Norway | Spanish |

-
Wetenschap © https://nl.scienceaq.com