Wetenschap
Onderzoekers helpen baanbrekende test van seriële kristallografietechniek
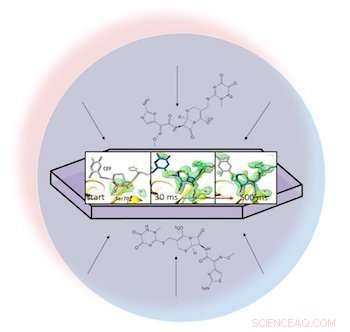
In een vloeistofdruppel (weergegeven door de lichtblauwe cirkel), een antibioticum verspreidt zich door een gekristalliseerd eiwit, bèta-lactamase, en bindt eraan. Met röntgenfoto's van het gebonden paar konden onderzoekers kaarten maken van de elektronendichtheid (groen) en een ring in het antibioticum zien openbreken (uiterst rechts) 30 tot 500 milliseconden nadat de reactie begon. Krediet:Marius Schmidt/ Universiteit van Wisconsin Milwaukee
Wetenschappers van Rice University gebruikten een snel pulserende röntgenlaser om te laten zien hoe resistente tuberculosebacteriën de antibioticummoleculen die bedoeld zijn om de dodelijke longziekte te behandelen, deactiveren.
Rijstbiochemicus George Phillips en afgestudeerde student en co-hoofdauteur Jose Olmos maken deel uit van het door de National Science Foundation ondersteunde BioXFEL Center dat de baanbrekende proof-of-principal resultaten heeft vastgelegd door middel van een techniek genaamd mix-and-inject seriële kristallografie.
Hiervoor was het gebruik van een nieuwe tool nodig, een röntgenvrije-elektronenlaser (XFEL) die een serieuze upgrade belooft voor de nauwgezette, eeuwenoud proces van karakterisering van moleculen door middel van röntgenspectroscopie. De laser bevindt zich in het SLAC National Accelerator Laboratory van het Department of Energy aan de Stanford University.
Het definiëren van moleculaire structuren is essentieel om te begrijpen hoe ze functioneren, zei Philips. De nieuwe ontdekking toont het zich snel ontwikkelende vermogen van wetenschappers aan om snapshots te maken van dynamische biologische processen terwijl ze plaatsvinden.
Trouw aan zijn naam, de mix-and-inject-techniek voert een smalle stroom gekristalliseerde moleculen in een oplossing naar de laser. Wanneer de laser een kristal raakt met een puls van 20 femtoseconden (quadrillionste van een seconde), het vernietigt het kristal - maar niet voordat een diffractiepatroon is geproduceerd op een detector die de atomaire structuur van het molecuul laat zien.
In een open access paper in BMC Biology, de onderzoekers onder leiding van Marius Schmidt, een professor aan de Universiteit van Wisconsin-Milwaukee, beschreef het mengen van het antibioticum ceftriaxon met een resistent enzym dat door bacteriën wordt gebruikt, bèta-lactamase, en het naar de pulserende laser voeren. Omdat ze de tijd tussen mengen en aankomst bij de laser konden aanpassen, ze legden diffractiepatronen van de gekristalliseerde moleculen vast, niet alleen in willekeurige oriëntaties, maar ook in verschillende stadia van interactie.
"Hoewel er elegante studies zijn geweest om eiwitbewegingen te observeren met door licht veroorzaakte veranderingen, ons werk illustreert dat een grotere klasse van eiwitten, namelijk enzymen, kan op een tijdsopgeloste manier worden onderzocht bij LCLS (Linac Coherent Light Source) en andere XFEL's, ' zei Olmos.
Phillips zei dat het experiment het nut van XFEL bewees om diffractiepatronen te vangen van kristallen met een diameter van een miljoenste van een meter of minder, veel kleiner dan eerdere technieken. "Dit zal ons meer leren over hoe de natuur deze moleculen heeft geselecteerd en ontworpen om te werken, " zei hij. "Het is niet anders dan een fiets zien trappen:je krijgt meer dan een statisch beeld en een beter begrip van hoe het werkt.
"Elke keer als je een eiwit wilt engineeren of een moleculaire machine wilt recreëren, meer weten over hoe ze op een fundamenteel niveau werken, zal nuttig zijn, of het nu gaat om het afbreken van cellulose voor biobrandstoffen of het ontwerpen van een nieuw medicijn of het verbeteren van een bestaand medicijn."
In zijn presentaties Phillips vergelijkt het vermogen om snapshots van eiwitten in actie te maken met 19e-eeuwse beelden van Eadweard Muybridge die de beweging midden in de rit van een galopperend paard vastlegden. (Per toeval, het paard was eigendom van de oprichter van Stanford.)
De onderzoekers verwachten de binnenkort te upgraden XFEL op Stanford, een nieuwe faciliteit in Europa en anderen in de maak over de hele wereld zullen wetenschappers in staat stellen om structuren in minuten in plaats van dagen vast te leggen en hen meer gedetailleerde gegevens over chemische processen te geven.
Phillips heeft goede hoop dat de verbeterde tools ook zullen helpen de structuren van moleculen vast te leggen zonder ze eerst te hoeven kristalliseren.
"Als we de röntgenstraal en de achtergrondverstrooiing klein genoeg kunnen krijgen en de uitleesstraal schoon genoeg, dan in theorie in plaats van paraderende kristallen, we zouden enkele moleculen in de laser kunnen paraderen om diffractiepatronen op te bouwen, " hij zei.
"De Stanford-laser vuurt nu op 100 hertz (cycli per seconde), " zei Phillips. "De Europese XFEL gaat om 10 uur schieten, 000 hertz. Dat is een behoorlijke upgrade, want het geeft ons veel meer kansen om de moleculen te raken terwijl ze binnenstromen."
Hij zei dat het centrum uiteindelijk hoopt structurele gegevens voor moleculaire reacties vast te leggen.
"Het kunnen twee eiwitten zijn die samenkomen en elkaar leren herkennen, het kan de interactie zijn van een virus met een antilichaam, het kan de interactie zijn van een substraat met een enzym of iets wat je kunt doen door te mengen of met externe stimulatie, ' zei Phillips. 'Als je dat eenmaal kunt, alles is mogelijk."
 De effecten van zoutconcentratie op bacteriegroei
De effecten van zoutconcentratie op bacteriegroei Zijn antivitamines de nieuwe antibiotica?
Zijn antivitamines de nieuwe antibiotica? Ontwikkeling van nieuw eiwit kan leiden tot nieuwe behandelingsopties voor kanker, aangeboren afwijkingen
Ontwikkeling van nieuw eiwit kan leiden tot nieuwe behandelingsopties voor kanker, aangeboren afwijkingen Onderzoekers onderzoeken manieren om antibiotica te verwijderen die meren en rivieren vervuilen
Onderzoekers onderzoeken manieren om antibiotica te verwijderen die meren en rivieren vervuilen De smaak behouden, het verminderen van het zout
De smaak behouden, het verminderen van het zout
 Finse batterijplannen wekken milieuvrees op
Finse batterijplannen wekken milieuvrees op De dodelijkste vulkaanuitbarstingen van de afgelopen 25 jaar
De dodelijkste vulkaanuitbarstingen van de afgelopen 25 jaar Hoe het argument te beantwoorden dat de uitstoot van Australië te klein is om een verschil te maken?
Hoe het argument te beantwoorden dat de uitstoot van Australië te klein is om een verschil te maken? Brandweerlieden in Brazilië racen om branden in wetland te bedwingen
Brandweerlieden in Brazilië racen om branden in wetland te bedwingen Nieuw internationaal initiatief benadrukt de noodzaak van wereldwijde actie tegen luchtvervuiling, aangezien de gevolgen voor de gezondheid groot blijven
Nieuw internationaal initiatief benadrukt de noodzaak van wereldwijde actie tegen luchtvervuiling, aangezien de gevolgen voor de gezondheid groot blijven
Hoofdlijnen
- Officiële vishandel onderschat wereldwijde vangsten enorm
- De structurele verschillen tussen zenuwen en bloedvaten
- De functie van NIMA-gerelateerd kinase 6 in de rechte groei van plantencellen
- Tonnen leven diep in het aardoppervlak gevonden
- Kenmerken van micro-organismen
- Bloem trekt insecten aan door zich voor te doen als paddenstoel
- Verschillen tussen Protozoa en Protisten
- Puin van de tsunami van 2011 bracht honderden soorten over de Stille Oceaan
- Studie werpt nieuw licht op hoe dieren en planten reageren op veranderingen in de omgeving
 Rotskunst en mysterie:oude kameelsculpturen in de Saoedische woestijn
Rotskunst en mysterie:oude kameelsculpturen in de Saoedische woestijn Bike to Work Week:zijn e-bikes het antwoord op gezondheid, verkeers- en milieuvraagstukken?
Bike to Work Week:zijn e-bikes het antwoord op gezondheid, verkeers- en milieuvraagstukken? Luchtvaartmaatschappijen kunnen de klimaatimpact met 10% verminderen door deze kleine wijzigingen in vluchten aan te brengen
Luchtvaartmaatschappijen kunnen de klimaatimpact met 10% verminderen door deze kleine wijzigingen in vluchten aan te brengen De eerste CubeSat met een Hall-effect boegschroef is de ruimte in gegaan
De eerste CubeSat met een Hall-effect boegschroef is de ruimte in gegaan Enquête meet blanken, Zwarten opvattingen over de Amerikaanse identiteit, geweren, politiek geweld
Enquête meet blanken, Zwarten opvattingen over de Amerikaanse identiteit, geweren, politiek geweld Rapportkaarten tonen aanhoudende zeespiegelstijging aan de oost- en de Golfkust
Rapportkaarten tonen aanhoudende zeespiegelstijging aan de oost- en de Golfkust Gegevens opslaan in DNA brengt de natuur in het digitale universum
Gegevens opslaan in DNA brengt de natuur in het digitale universum Sociale media bieden mkb-ers tools om internationaliseringsgerelateerde dreigingen te verminderen
Sociale media bieden mkb-ers tools om internationaliseringsgerelateerde dreigingen te verminderen
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com