
Wetenschap
Waarom komen waterstofbindingen voor in water?
1. Waterstructuur: Een watermolecuul (H₂O) bestaat uit twee waterstofatomen die zijn gebonden aan één zuurstofatoom.
2. Elektronegativiteit van Oxygen: Zuurstof is zeer elektronegatief, wat betekent dat het elektronen sterker aantrekt dan waterstof. Dit creëert een polaire covalente binding binnen het watermolecuul. Het zuurstofatoom verwerft een gedeeltelijke negatieve lading (Δ-), terwijl de waterstofatomen gedeeltelijke positieve ladingen verwerven (Δ+).
3. Waterstofbinding: Het gedeeltelijk positieve waterstofatoom van het ene watermolecuul wordt aangetrokken door het gedeeltelijk negatieve zuurstofatoom van een ander watermolecuul. Deze elektrostatische aantrekkingskracht wordt een waterstofbinding genoemd.
4. Belang: Waterstofbindingen zijn relatief zwak in vergelijking met covalente bindingen, maar ze zijn collectief sterk genoeg om veel van de unieke eigenschappen van water te beïnvloeden:
* Hoog kookpunt: Water heeft een verrassend hoog kookpunt voor zijn molecuulgewicht, vanwege de energie die nodig is om de waterstofbruggen tussen watermoleculen te doorbreken.
* Hoog smeltpunt: Vergelijkbaar met het kookpunt, dragen de sterke waterstofbindingen tussen watermoleculen bij aan het relatief hoge smeltpunt.
* Hoge oppervlaktespanning: Watermoleculen aan het oppervlak vormen sterke waterstofbruggen met elkaar, wat resulteert in hoge oppervlaktespanning.
* Universeel oplosmiddel: De polariteit van water en zijn vermogen om waterstofbindingen te vormen, maakt het een uitstekend oplosmiddel voor veel stoffen, waaronder zouten en suikers.
Samenvattend, de combinatie van de structuur van het water, de elektronegativiteit van zuurstof en de resulterende gedeeltelijke ladingen kunnen watermoleculen waterstofbindingen vormen, bijdragen aan zijn unieke eigenschappen en het essentieel maken voor het leven op aarde.
 Actie ondernemen om Net Zero in de landbouwsector te bereiken
Actie ondernemen om Net Zero in de landbouwsector te bereiken Vulkaan Alaska barst voor de tweede dag op rij uit; vliegtuigen gewaarschuwd
Vulkaan Alaska barst voor de tweede dag op rij uit; vliegtuigen gewaarschuwd Het zal moeilijk zijn, maar we kunnen de wereld voeden met plantaardig eiwit
Het zal moeilijk zijn, maar we kunnen de wereld voeden met plantaardig eiwit Nieuw-Zeeland investeert in de groei van zijn binnenlandse recyclingindustrie om banen te creëren en minder afval op stortplaatsen te dumpen
Nieuw-Zeeland investeert in de groei van zijn binnenlandse recyclingindustrie om banen te creëren en minder afval op stortplaatsen te dumpen Ter ere van gletsjers, die draken van ijs bekeken met zorg en fascinatie
Ter ere van gletsjers, die draken van ijs bekeken met zorg en fascinatie
Hoofdlijnen
- Wat zijn 3 functies van de navelstreng?
- Wanneer een mutatie voor het eerst gebeurt, wordt er verschillende allel gevormd, wat beschrijft het beste de frequentie van dit allel?
- Samengestelde gezichten van DNA helpen bij het oplossen van koude gevallen
- Second Life-gegevens bieden inzicht in hoe trends zich verspreiden
- Het belangrijkste doel van celdeling is?
- Begrijpen waarom BRCA2 verband houdt met het risico op kanker
- Wat is het verschil tussen een Centriole en een Centrosome?
- Hoe transporteren dragereiwitten stoffen door het celmembraan?
- Wat betekent investering in de wetenschap?
- Op de natuur geïnspireerde materialen kunnen worden gebruikt in toepassingen variërend van tunneling tot ruimtevaart

- Ultradun 2D cupraat met actieve periodieke koperen enkele sites, een nieuwe katalysator voor Chan-lam-koppeling
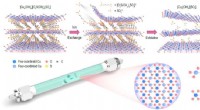
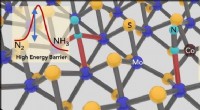
- Ammoniaksynthese gemakkelijk gemaakt met 2D-katalysator
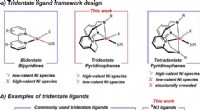
- Nieuw molecuul zet de toon voor nikkel als groenere fotokatalysator, onthult belangrijke stappen in reactieproces
- Materiaal met hoge brekingsindex behoudt een hoge doorlaatbaarheid na uitgloeien bij 850 ° C

 Archeologen vinden graven uit de Bronstijd, bekleed met goud
Archeologen vinden graven uit de Bronstijd, bekleed met goud Is het mogelijk om energie te zien?
Is het mogelijk om energie te zien?  Wat is oscillerende beweging?
Wat is oscillerende beweging?  Beheerde retraite kan steden opnieuw uitvinden en tegelijkertijd levens beschermen tegen de effecten van klimaatverandering
Beheerde retraite kan steden opnieuw uitvinden en tegelijkertijd levens beschermen tegen de effecten van klimaatverandering Wat de duivel? Prince of Darkness wordt verkeerd begrepen, zegt UCLA-professor
Wat de duivel? Prince of Darkness wordt verkeerd begrepen, zegt UCLA-professor  De afgestemde massademper:hoe de wetenschap de wolkenkrabbers van morgen aardbevingsbestendig kan maken
De afgestemde massademper:hoe de wetenschap de wolkenkrabbers van morgen aardbevingsbestendig kan maken  Wat is een oplossing in de wetenschap?
Wat is een oplossing in de wetenschap?  Wat is de belangrijkste ontdekking in de wetenschap?
Wat is de belangrijkste ontdekking in de wetenschap?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

