
Wetenschap
Welke massa NH3 heb je bereid uit de reactie van 10 g N2 met een overmaat aan H2?
Mol N2 =10 g / 28 g/mol =0,357 mol
Mol H2 =Overmaat (aangenomen oneindig)
De uitgebalanceerde chemische vergelijking voor de reactie is:
N2 + 3H2 -> 2NH3
Uit de stoichiometrie van de vergelijking zien we dat 1 mol N2 reageert met 3 mol H2 om 2 mol NH3 te produceren. Daarom is N2 in dit geval de beperkende reactant.
Nu kunnen we het aantal geproduceerde mol NH3 berekenen:
Mol NH3 =0,357 mol N2 * (2 mol NH3 / 1 mol N2) =0,714 mol NH3
Ten slotte berekenen we de geproduceerde massa NH3 met behulp van de molaire massa:
Massa NH3 =0,714 mol * 17 g/mol =12,14 g
Er wordt dus 12,14 g NH3 geproduceerd uit de reactie van 10 g N2 met een overmaat H2.
 Hoe ontstaat kokend water?
Hoe ontstaat kokend water?  Wat is de juiste formule-eenheid voor de combinatie van koperII-ionen en Cl-chloride?
Wat is de juiste formule-eenheid voor de combinatie van koperII-ionen en Cl-chloride?  Slangenbeet? Chemici bedenken hoe ze de verspreiding van gif gemakkelijk en goedkoop kunnen stoppen
Slangenbeet? Chemici bedenken hoe ze de verspreiding van gif gemakkelijk en goedkoop kunnen stoppen  Op weg naar nieuwe veelbelovende ferro-elektrische materialen van het perovskiettype:hogedruksynthese van rubidiumniobaat
Op weg naar nieuwe veelbelovende ferro-elektrische materialen van het perovskiettype:hogedruksynthese van rubidiumniobaat  Wat is het residu van het destillatieproces?
Wat is het residu van het destillatieproces?
 Nieuw VN-rapport roept op tot dringende hulp voor oceanen ter wereld
Nieuw VN-rapport roept op tot dringende hulp voor oceanen ter wereld De tijd om op te treden voor een wereldwijd duurzame veestapel is nu
De tijd om op te treden voor een wereldwijd duurzame veestapel is nu Hoe het Chicxulub-impactor aanleiding gaf tot moderne regenwouden
Hoe het Chicxulub-impactor aanleiding gaf tot moderne regenwouden Extreem droog, warme omstandigheden dit najaar, waardoor vroege, gedempte gebladerteweergave
Extreem droog, warme omstandigheden dit najaar, waardoor vroege, gedempte gebladerteweergave Onderzoek wijst uit dat arseen tientallen jaren na het einde van de blootstelling kanker kan veroorzaken
Onderzoek wijst uit dat arseen tientallen jaren na het einde van de blootstelling kanker kan veroorzaken
Hoofdlijnen
- Een veranderend klimaat, wijn wisselen
- Wat is de rol van ademhalingssystemen in homeostase?
- Hoe CRABS CLAW TORNADO 2 onderdrukt bij de ontwikkeling van planten
- Hoe sperma het genoom van vader uitpakt, zodat het kan samensmelten met dat van moeder
- Killer-tandpijn veroorzaakt waarschijnlijk ellende voor orka's in gevangenschap
- Hoe Kudzu werkt
- In de stad levende pimpelmezen kunnen grotere eieren leggen vanwege wat ze eten
- Hoe visvinnen evolueerden vlak voor de overgang naar land
- Onderzoekers ontdekken hoe ze celsignalerende moleculen als doelwitten in kaart kunnen brengen
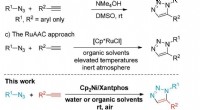
- Team presenteert nieuwe synthesemethode voor klikchemie
- Hersenziekten diagnosticeren? Een massaspectrometriebeeldvorming kan u op een dag helpen
- Water efficiënter omzetten in waterstof

- Studie werpt nieuw licht op productie van hydroxylradicalen, die helpen bij het afbreken van luchtverontreinigende stoffen

- Nemen van de inlandse superfood mainstream van Australië

 NASA voltooit mijlpaal in de richting van stiller supersonisch X-vliegtuig
NASA voltooit mijlpaal in de richting van stiller supersonisch X-vliegtuig Iets produceerde een verrassende piek van methaan op Mars
Iets produceerde een verrassende piek van methaan op Mars  Deepfake-video's vormen een bedreiging, maar dumbfas zijn misschien erger
Deepfake-video's vormen een bedreiging, maar dumbfas zijn misschien erger Banden tussen nieuwe medewerkers leiden tot vroeg succes
Banden tussen nieuwe medewerkers leiden tot vroeg succes Stedelijke hitte en koude eilandeffecten gecontroleerd door landbouw en irrigatie
Stedelijke hitte en koude eilandeffecten gecontroleerd door landbouw en irrigatie Koemelkdeeltjes die worden gebruikt voor effectieve orale toediening van medicijnen
Koemelkdeeltjes die worden gebruikt voor effectieve orale toediening van medicijnen  Wat zijn de afkortingen voor vloeistofmetingen?
Wat zijn de afkortingen voor vloeistofmetingen?  NASA's Groenland-missie verrast nog steeds in jaar vier
NASA's Groenland-missie verrast nog steeds in jaar vier
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

