
Wetenschap
Siliciumdioxide gebruiken als voorbeeld en de periodiek systeem A referentie.
1. Identificeer de elementen
* Silicium (SI) bevindt zich in groep 14 (IVA) van het periodiek systeem.
* Zuurstof (O) bevindt zich in groep 16 (via) van de periodiek systeem.
2. Bepaal het aantal valentie -elektronen
* Silicium heeft 4 valentie -elektronen (het is in groep 14).
* Zuurstof heeft 6 valentie -elektronen (het is in groep 16).
3. Bepaal het gewenste aantal obligaties
* Silicium moet 4 bindingen vormen om een stabiel octet te bereiken (8 elektronen in zijn buitenste schaal).
* Zuurstof moet 2 bindingen vormen om een stabiel octet te bereiken.
4. Zoek de eenvoudigste ratio
* Om aan de bindingsvereisten te voldoen, kan één siliciumatoom binden met twee zuurstofatomen. Dit wordt weergegeven door de formule Sio₂ .
5. Schrijf de formule
* De formule van de covalente verbinding wordt geschreven met het element dat eerst minder elektronegatief is (in dit geval silicium), gevolgd door het element dat meer elektronegatief is (zuurstof). De subscripts geven het aantal atomen van elk element in het molecuul aan.
Sleutelpunten:
* Covalente verbindingen: Atomen delen elektronen om stabiliteit te bereiken.
* elektronegativiteit: Een maat voor het vermogen van een atoom om elektronen aan te trekken. Het meer elektronegatief atoom wordt meestal als laatste in de formule geschreven.
* octetregel: De meeste atomen streven ernaar acht elektronen in hun buitenste schaal te hebben (behalve voor waterstof, die er twee zoekt).
Laten we eens kijken naar een ander voorbeeld:
koolstofdioxide (co₂)
* koolstof (Groep 14) heeft 4 valentie -elektronen.
* zuurstof (Groep 16) heeft 6 valentie -elektronen.
* Eén koolstofatoom kan dubbele bindingen vormen met twee zuurstofatomen, die voldoen aan de octetregel voor alle atomen.
Daarom is de formule voor koolstofdioxide co₂.
 Supersmering op microschaal zou de weg kunnen effenen voor toekomstige verbeterde elektromechanische apparaten
Supersmering op microschaal zou de weg kunnen effenen voor toekomstige verbeterde elektromechanische apparaten Wat is geen element water waterstofzuurstof koolstofchloor?
Wat is geen element water waterstofzuurstof koolstofchloor?  Wat bedoel je met evenwichtsconstante?
Wat bedoel je met evenwichtsconstante?  Een nieuwe syntheseroute voor alternatieve katalysatoren van edelmetalen
Een nieuwe syntheseroute voor alternatieve katalysatoren van edelmetalen Metaal-organisch raamwerkonderzoek boekt belangrijke vooruitgang in de richting van het verwijderen van pesticiden uit grondwater
Metaal-organisch raamwerkonderzoek boekt belangrijke vooruitgang in de richting van het verwijderen van pesticiden uit grondwater
 Beïnvloedt waterschaarste productiebedrijven om giftige emissies te verminderen?
Beïnvloedt waterschaarste productiebedrijven om giftige emissies te verminderen? Levenscyclus van een geverfde Dame Butterfly
Levenscyclus van een geverfde Dame Butterfly Hoe praat je over klimaatverandering:benadruk de nadelen, geen voordelen, om gedrag te veranderen
Hoe praat je over klimaatverandering:benadruk de nadelen, geen voordelen, om gedrag te veranderen De opwarming van de aarde kan de modulatie van het ontstaan van tropische cyclonen intensiveren door intra-seizoensschommelingen in de zomer
De opwarming van de aarde kan de modulatie van het ontstaan van tropische cyclonen intensiveren door intra-seizoensschommelingen in de zomer  Boek onderzoekt verband tussen gender en kookenergie in Sub-Sahara Afrika
Boek onderzoekt verband tussen gender en kookenergie in Sub-Sahara Afrika
Hoofdlijnen
- Wat wetenschapscommunicatoren kunnen leren door naar mensen te luisteren
- Nieuw inzicht in waarom de ziekte van Pierce zo dodelijk is voor wijnstokken
- Hoe verandert een verhouding van oppervlakte -oppervlak tot volume naarmate de cel groter wordt?
- Welk type lipide wordt door het lichaam gebruikt om hormonen te maken?
- Macht overdragen aan staten zal de bescherming van bedreigde diersoorten niet verbeteren
- Welke soorten planten worden gebruikt om alcohol te maken?
- Hoe plantencellen het potentieel voor zelfbeschadiging neutraliseren
- Wat de afnemende kariboe-populaties en het totale jachtverbod betekenen voor de Inuit-gemeenschappen in Labrador
- Hoe wetenschappers doen wetenschap?
- Team test de effecten van zuurstof op uranium

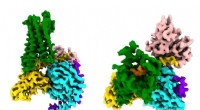
- CryoEM-onderzoek legt opioïde-signalering vast
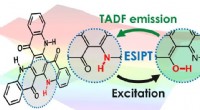
- Gebruik maken van hoppende waterstofatomen voor zeer efficiënte OLED's
- Olie opruimen met magneten
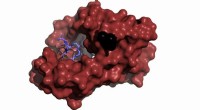
- Mutaties in het belangrijkste eiwit dat toezicht houdt op cellulaire functies die cruciaal zijn voor gezondheid en overleving
 Corruptiebesmetting:hoe juridische en financiële bedrijven een groter risico lopen op corruptie
Corruptiebesmetting:hoe juridische en financiële bedrijven een groter risico lopen op corruptie Welk deel van de aarde vormt de landmassa?
Welk deel van de aarde vormt de landmassa?  Wildvuur neemt toe sinds 1984 in de kustgebieden van Noord-Californië
Wildvuur neemt toe sinds 1984 in de kustgebieden van Noord-Californië Wetenschappers gebruiken licht om virale activiteit om te schakelen en ladingen naar cellen te brengen
Wetenschappers gebruiken licht om virale activiteit om te schakelen en ladingen naar cellen te brengen De maan en planeten schijnen door welk zonlicht?
De maan en planeten schijnen door welk zonlicht?  Duizenden vluchten voor nieuwe brand in Californië, gouverneur vraagt om hulp
Duizenden vluchten voor nieuwe brand in Californië, gouverneur vraagt om hulp Welke wetenschappelijke regel stelt dat de drijvende kracht op een object gelijk is aan het gewicht van de vloeistof die door objecten wordt verplaatst?
Welke wetenschappelijke regel stelt dat de drijvende kracht op een object gelijk is aan het gewicht van de vloeistof die door objecten wordt verplaatst?  Hoe zijn de fundamentele en afgeleide grootheden gerelateerd?
Hoe zijn de fundamentele en afgeleide grootheden gerelateerd?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

