
Wetenschap
Wat bedoel je met evenwichtsconstante?
Hier is een uitsplitsing van het concept:
Omkeerbare reacties:
- Veel chemische reacties zijn omkeerbaar , wat betekent dat ze in beide richtingen kunnen doorgaan.
- Forward Reaction: Reactanten transformeren in producten.
- Omgekeerde reactie: Producten veranderen terug in reactanten.
evenwicht:
- bij evenwicht , De snelheden van de voorwaartse en omgekeerde reacties zijn gelijk.
- Dit betekent dat de concentraties van reactanten en producten in de loop van de tijd constant blijven.
evenwichtsconstante (k):
- k is een specifiek nummer voor een gegeven reactie bij een specifieke temperatuur.
- Het wordt berekend door het product te delen van de concentraties van de producten (verhoogd tot hun stoichiometrische coëfficiënten) door het product van de concentraties van de reactanten (verhoogd tot hun stoichiometrische coëfficiënten).
- voor de algemene reactie:
A A + B B ⇌ C C + D D
K =([c]^c * [d]^d) / ([a]^a * [b]^b)
wat K ons vertelt:
- k> 1: De reactie bevordert productvorming bij evenwicht.
- K <1: De reactie bevordert de vorming van reactant bij evenwicht.
- k =1: De reactie is in evenwicht, zonder significante voorkeur voor producten of reactanten.
factoren die K: beïnvloeden
- Temperatuur: K verandert met temperatuur.
- Druk: K wordt alleen beïnvloed door druk voor reacties met gassen.
- concentratie: Veranderende concentraties van reactanten of producten veranderen niet, maar het zal de evenwichtspositie verschuiven om de K-waarde te herstellen.
Toepassingen:
- Voorspelling van de omvang van een reactie.
- Inzicht in de factoren die de voorkeur geven aan product- of reactantvorming.
- Het ontwerpen en optimaliseren van chemische processen.
Voorbeelden:
- De reactie van waterstof en jodium om waterstofjodide te vormen heeft een grote K -waarde, wat aangeeft dat de vorming van waterstofjodide de voorkeur heeft bij evenwicht.
- De reactie van water en koolstofdioxide om koolzuur te vormen heeft een kleine K -waarde, wat aangeeft dat de vorming van koolzuur niet de voorkeur heeft in evenwicht.
Inzicht in het concept van de evenwichtsconstante is cruciaal op veel gebieden van chemie, waaronder kinetiek, thermodynamica en analytische chemie.
 PH niveau van regenwater
PH niveau van regenwater
Regenwater is van nature enigszins zuur, met een pH van ongeveer 5,0. Natuurlijke variaties en menselijke vervuilers kunnen ervoor zorgen dat de regen zuurder wordt. Afhankelijk van de regio, het seizoen en de aanwezigheid
 Welke verbindingen en elementen gevonden in mango?
Welke verbindingen en elementen gevonden in mango?  Hoe de Amerikaanse waterstofbomgeheimen verdwenen
Hoe de Amerikaanse waterstofbomgeheimen verdwenen  Wat doen bicarbonaationen?
Wat doen bicarbonaationen?  Definitie van zure oplossing
Definitie van zure oplossing
 COVID-19 biedt zeldzame kansen om natuurlijke en menselijke systemen te bestuderen
COVID-19 biedt zeldzame kansen om natuurlijke en menselijke systemen te bestuderen Een natuurlijk tintje voor kustverdediging:hybride oplossingen kunnen meer voordelen bieden in gebieden met een lager risico
Een natuurlijk tintje voor kustverdediging:hybride oplossingen kunnen meer voordelen bieden in gebieden met een lager risico  Toxiciteit van metalen uit sedimenten van de rivier Deba
Toxiciteit van metalen uit sedimenten van de rivier Deba Sterke onderzeese aardbeving schudt Indonesië; geen tsunami-waarschuwing
Sterke onderzeese aardbeving schudt Indonesië; geen tsunami-waarschuwing Visserij in Tasmanië gekookt door recordbrekende hittegolf op zee
Visserij in Tasmanië gekookt door recordbrekende hittegolf op zee
Hoofdlijnen
- Apple-klinieken voor uw gezondheid? Het gebeurde bijna zomaar
- Mutaties die veroudering beïnvloeden:vaker voorkomend dan we dachten?
- Wat is de functie van begeleidende cellen?
- Losse huid en slap volume beschermen Hagfish tegen haaienbeten
- Nieuwe functie in genregulerend eiwit ontdekt
- Praktijken en overtuigingen die wetenschappelijk zijn gebaseerd?
- De twee belangrijkste manieren waarop neuronen in staat zijn om stimuli te reageren?
- Wat zou het wetenschappelijke antwoord zijn op wat zijn vier delen een conclusie?
- DNA wordt beschreven als het molecuul van?
- Een methode om verborgen serienummers van polymeerproducten te herstellen

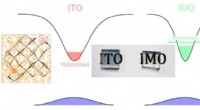
- Wetenschappers ontwerpen ontdekking verdubbelt geleidbaarheid van indiumoxide transparante coatings
- Het regent diamanten in het universum, suggereert onderzoek

- Watervrije manier om MXenes te maken kan nieuwe toepassingen betekenen voor de veelbelovende nanomaterialen

- Nieuwe klasse zonnecellen, gebruik van loodvrije perovskietmaterialen

 Op zoek naar natuurlijke oplossingen voor een door de mens gemaakt probleem
Op zoek naar natuurlijke oplossingen voor een door de mens gemaakt probleem Er is meer nodig dan massale protesten om verandering teweeg te brengen
Er is meer nodig dan massale protesten om verandering teweeg te brengen Vrij radicaal verwijderen Wat uit moleculen?
Vrij radicaal verwijderen Wat uit moleculen?  Een gewone parasiet zou medicijnen naar de hersenen kunnen brengen – hoe wetenschappers Toxoplasma gondii van vijand in vriend veranderen
Een gewone parasiet zou medicijnen naar de hersenen kunnen brengen – hoe wetenschappers Toxoplasma gondii van vijand in vriend veranderen  Verschuiving naar meer intense regens bedreigt historische Italiaanse wijnmakerij
Verschuiving naar meer intense regens bedreigt historische Italiaanse wijnmakerij Het publiekelijk delen van een doel kan je helpen vol te houden nadat je hebt gefaald
Het publiekelijk delen van een doel kan je helpen vol te houden nadat je hebt gefaald Biodiesel maken met groene oplosmiddelen
Biodiesel maken met groene oplosmiddelen Afbeelding:De evolutie van supernova 1987A
Afbeelding:De evolutie van supernova 1987A
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

