
Wetenschap
Welk type bindingen tussen de zwavel- en zuurstofatomen?
Dit is waarom:
* elektronegativiteit: Zuurstof is elektronegatiefer dan zwavel. Dit betekent dat zuurstof een sterkere aantrekkingskracht heeft op elektronen.
* Elektronen delen: Het verschil in elektronegativiteit is niet groot genoeg om een volledige overdracht van elektronen te veroorzaken (die een ionische binding zouden creëren). In plaats daarvan delen de zwavel- en zuurstofatomen elektronen om covalente bindingen te vormen.
Voorbeelden:
* zwaveldioxide (SO2): Er bestaan twee covalente bindingen tussen elk zwavelatoom en elk zuurstofatoom.
* zwaveltrioxide (SO3): Er bestaan drie covalente bindingen tussen elk zwavelatoom en elk zuurstofatoom.
Belangrijke opmerking: Hoewel de bindingen voornamelijk covalent zijn, hebben ze vanwege het verschil in elektronegativiteit vaak een mate van polariteit . Dit betekent dat de elektronen niet gelijk worden gedeeld, wat leidt tot een lichte negatieve lading op de zuurstofatomen en een lichte positieve lading op het zwavelatoom.
 Dieren gevonden in de regio Piemonte van Georgia
Dieren gevonden in de regio Piemonte van Georgia  Methaan:emissies nemen toe en dat is geen goed nieuws
Methaan:emissies nemen toe en dat is geen goed nieuws Team bestudeert evolutie van activisme tegen klimaatverandering
Team bestudeert evolutie van activisme tegen klimaatverandering Kunnen Amerikaanse staten het zich veroorloven om tegen 2050 de netto-emissiedoelstellingen te halen?
Kunnen Amerikaanse staten het zich veroorloven om tegen 2050 de netto-emissiedoelstellingen te halen? Braziliaans Amazonegebied registreert minste septemberbranden in 20 jaar
Braziliaans Amazonegebied registreert minste septemberbranden in 20 jaar
Hoofdlijnen
- Een systematische review van drie belangrijke suikermetabolisme-eiwitten:HXK, SnRK1 en TOR
- Welke gebeurt direct voordat u een hypothese vormt?
- Wat zijn de 3 bronnen van genetische variatie?
- Wordt uw huisdier blootgesteld aan passief roken? Dit zijn de (ernstige) gezondheidsrisico’s
- Waarom zou wetenschapper embryo's bestuderen?
- Wat wordt door wetenschappers gebruikt om iets uit te leggen dat we niet kunnen zien of begrijpen?
- De symbolische aap? Door tokens gemedieerde economische keuzes in getufte kapucijnen
- Inspanningen zijn bedoeld om de verspreiding van vuurmieren in de VS te beperken
- Nieuwe bevindingen suggereren hoe en waarom temperaturen het geslacht van schildpadden bepalen
- Alcoholen vertonen kwantumeffecten
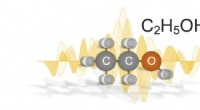
- Suikermoleculen gebruiken om katoenmateriaal te laten gloeien

- Verontreinigende stoffen uit water verwijderen met stuifmeel en sporen - zonder de achoo!
- Bruggen bouwen in de cel – met licht
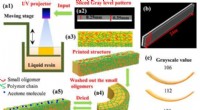
- 4D-printen van omkeerbare vormveranderende materialen met op licht gebaseerde grijswaardenpatronen
 Oost-China aangewezen als bron van schadelijke ozonafbrekende emissies
Oost-China aangewezen als bron van schadelijke ozonafbrekende emissies Wat is de laagste graad van foliated metamorfe rock?
Wat is de laagste graad van foliated metamorfe rock?  Honderden oude grondwerken gebouwd in de Amazone
Honderden oude grondwerken gebouwd in de Amazone Welke laag aarde vormt de continenten?
Welke laag aarde vormt de continenten?  Een magneet gemaakt van een stalen paperclip is waarschijnlijk een?
Een magneet gemaakt van een stalen paperclip is waarschijnlijk een?  Shell beval om zijn uitstoot te verminderen:uitspraak kan van invloed zijn op bijna elk groot bedrijf ter wereld
Shell beval om zijn uitstoot te verminderen:uitspraak kan van invloed zijn op bijna elk groot bedrijf ter wereld Wat is een elektrische eigenschap van materie die interactie met elektrische en magnetische krachten creëert?
Wat is een elektrische eigenschap van materie die interactie met elektrische en magnetische krachten creëert?  Wat is het gebied van een longitudinale golf waarin dichtheid en druk minder dan normaal zijn?
Wat is het gebied van een longitudinale golf waarin dichtheid en druk minder dan normaal zijn?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

