
Wetenschap
CryoEM-onderzoek legt opioïde-signalering vast
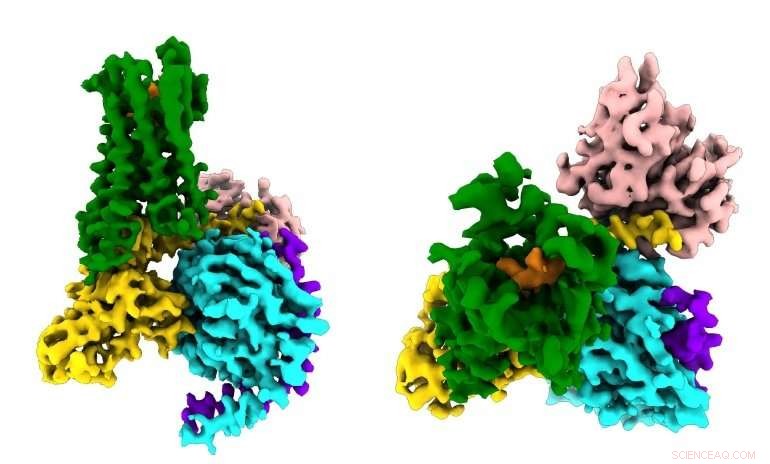
Onderzoekers zien voor het eerst hoe een synthetisch opioïde medicijn (oranje) zich bindt aan de µ-opioïde receptoren (groen) in de hersenen, en activeren signaalmoleculen in neuronen (G⍺s in goud, Gβ in cyaan, Gγ in paars) die leiden tot pijnonderdrukking en verslaving. Credit:Antoine Koehl (Manglik-lab)
Opioïde medicijnen zoals morfine en fentanyl zijn een steunpilaar van de moderne pijnmedicatie. Maar ze veroorzaken ook constipatie, zijn zeer verslavend, en kan leiden tot dodelijke ademhalingsinsufficiëntie als het in een te hoge dosis wordt ingenomen. Wetenschappers hebben lang geprobeerd nieuwe opioïde medicijnen te ontwikkelen die pijn kunnen verdrijven zonder deze gevaarlijke bijwerkingen, maar gaten in ons begrip van hoe opioïden hun verschillende effecten op biologisch niveau precies uitoefenen, hebben deze droom tot nu toe op afstand gehouden.
Opioïde pijnstillers werken door zich te binden aan een receptoreiwit dat aanwezig is op zenuwcellen, de µ-opioïdereceptor, die evolueerde om te reageren op de natuurlijke pijnstillers van het lichaam (zoals de endorfines die door inspanning worden geproduceerd) door pijn te verminderen en een gevoel van euforie te creëren. Opioïde drugs, van opium tot morfine tot heroïne, kapen dit signaalsysteem door zich aan hetzelfde receptormolecuul te binden. Maar details over hoe het activeren van deze receptoren de positieve en negatieve effecten van de medicijnen activeert, zijn vaag gebleven.
Nutsvoorzieningen, in een studie gepubliceerd op 13 juni, 2018 in Natuur , wetenschappers van UC San Francisco en Stanford University hebben cryo-elektronenmicroscopie met ultrahoge resolutie (cryoEM) gebruikt om het meest gedetailleerde portret ooit vast te leggen van een opioïde medicijn dat de biochemische signaalcascade activeert die het zijn kracht geeft - zowel ten goede als ten kwade .
"We hebben deze signaleringsgebeurtenis in wezen op heterdaad vastgelegd, " zei co-senior auteur Aashish Manglik, MD, doctoraat, een assistent-professor farmaceutische chemie aan de UCSF's School of Pharmacy, die de nieuwe studie uitvoerde als een afgestudeerde student en Distinguished Fellow aan Stanford. "Deze nieuwe beelden op atomair niveau zullen ons hopelijk in staat stellen om rationeel verbindingen te ontwerpen die gericht zijn op verschillende aspecten van opioïde signalering in de hersenen, in de hoop nieuwe, veiligere pijnstillers."
De µ-opioïde receptor maakt deel uit van een grote familie van honderden signaaleiwitten die G-proteïne-gekoppelde receptoren (GPCR's) worden genoemd en die bij alles betrokken zijn, van zicht en gehoor tot de reactie van het immuunsysteem op invasieve pathogenen, en zijn het doelwit van meer dan 30 procent van de moderne drugs. De meeste GPCR's delen dezelfde basismechanismen:wanneer het juiste signaalmolecuul (bijvoorbeeld een opioïde) bindt aan een GPCR aan de buitenkant van de cel, het eiwit stimuleert een kettingreactie van biochemische signalen in de cel door een boodschappermolecuul te activeren dat een G-eiwit wordt genoemd (vandaar de naam GPCR).
Experimenten die onthulden hoe een ander type GPCR zich bindt aan het "stimulerende" G-eiwit, leidden tot een Nobelprijs voor Brian Kobilka van Stanford, MD, een van de senior auteurs van de nieuwe studie, maar onderzoekers weten al tientallen jaren dat GPCR's ook kunnen binden aan wel een dozijn andere signaalmoleculen in de cel. Bijvoorbeeld, µ-opioïde receptoren activeren doorgaans alleen zogenaamde "remmende" G-eiwitten, die het tegenovergestelde effect hebben van de stimulerende G-eiwitcascade. Echter, wetenschappers weten niet zeker wat de affiniteit van sommige GPCR's voor bepaalde partnereiwitten in de cel veroorzaakt, of wat precies de gevolgen zijn.
Onderzoekers hopen dat door deze verschillende routes van GPCR-signalering te begrijpen, ze kunnen medicijnen ontwikkelen met zeer specifieke effecten, zoals het onderdrukken van pijn zonder verslaving te veroorzaken. Maar tot nu toe, onderzoekers hadden weinig idee hoe een bepaalde GPCR selectief interageert met slechts een subset van signaalpartners in de cel.
De nieuwe studie, gepubliceerd op 13 juni 2018 in Natuur , voor het eerst vastgelegd hoe de µ-opioïde receptor zich bindt aan zijn remmende G-eiwitpartner. Onder andere bevindingen, de studie toonde aan dat de selectiviteit van de receptor te wijten lijkt te zijn aan de kleine omvang van de bindingsholte voor het G-eiwit aan de binnenkant van de cel, terwijl het stimulerende G-eiwit een grotere bindingsplaats vereist.
Manglik werkte eerder samen met het computational drug discovery lab van Brian Shoichet, doctoraat, een professor in de farmaceutische chemie aan de UCSF's School of Pharmacy, om een molecuul genaamd PZM21 te identificeren dat ervoor zorgt dat de µ-opioïde receptor alleen het remmende G-eiwit aangrijpt, maar niet een ander signaalmolecuul dat bèta-arrestine wordt genoemd, en toonde aan dat dit selectieve medicijn pijnverlichting gaf met verminderde bijwerkingen bij muizen. Zijn lab bouwt nu voort op de nieuwe, portret met hoge resolutie van opioïde receptor - G-eiwitcomplex om nieuwe, nog selectievere verbindingen.
 Nieuwe methode maakt fotograferen van enzymen mogelijk
Nieuwe methode maakt fotograferen van enzymen mogelijk Vacaturedynamiek op met CO bedekte Pt(111)-elektroden
Vacaturedynamiek op met CO bedekte Pt(111)-elektroden Elektrische draadeigenschappen van DNA gekoppeld aan kanker
Elektrische draadeigenschappen van DNA gekoppeld aan kanker Nieuwe strategie verbetert de stabiliteit van metaalkatalysatoren uit de platinagroep
Nieuwe strategie verbetert de stabiliteit van metaalkatalysatoren uit de platinagroep Een systeem voor vroegtijdige waarschuwing voor schade in composietmaterialen
Een systeem voor vroegtijdige waarschuwing voor schade in composietmaterialen
Hoofdlijnen
- De genetica van Biracial-kenmerken
- Dennen kappen:eerder vroeger dan later doen is beter voor fynbos
- Veldonderzoek heeft tot doel de verspreiding van door teken overgedragen ziekten in het Midwesten te vertragen
- Studie van zeedieren suggereert dat het zenuwstelsel meerdere keren onafhankelijk is geëvolueerd
- Gentherapie kan kreupelheid bij paarden genezen, onderzoek vindt
- Wetenschappers identificeren het verband tussen licht en chloroplastontwikkeling
- Doorbreken van peulvruchten gewas wilde relatieve barrière
- Maki's darmmicrobioom sterk beïnvloed door sociale kringen, studie zegt:
- Hoe biologische antropologie werkt
- Biomoleculen lokaliseren met nanometernauwkeurigheid
- Het vriespunt berekenen

- Kunstmatige zuurstokken om virussen te blokkeren
- Dankzij subtiele ioninteracties op moleculair niveau kunnen wetenschappers het smeltpunt van ionische verbindingen afstemmen
- Onderzoekers creëren eerste koolstofvezels met uniforme poreuze structuur
 Een spaghetti- en marshmallow-toren bouwen
Een spaghetti- en marshmallow-toren bouwen  Egyptes vruchtbare Nijldelta bedreigd door klimaatverandering
Egyptes vruchtbare Nijldelta bedreigd door klimaatverandering Nexstar wint goedkeuring voor Tribune Media in laatste consolidatie
Nexstar wint goedkeuring voor Tribune Media in laatste consolidatie Zwaar, kortlevend elementair deeltje zou kunnen helpen het begrip van het universum te verfijnen
Zwaar, kortlevend elementair deeltje zou kunnen helpen het begrip van het universum te verfijnen Versterkte hoge tunnelgroeistructuren zijn bestand tegen cycloonwinden
Versterkte hoge tunnelgroeistructuren zijn bestand tegen cycloonwinden Afbeelding:De genetica van organismen in de ruimte bestuderen
Afbeelding:De genetica van organismen in de ruimte bestuderen Geconfronteerd met industriële achteruitgang, Wales droomt van Silicon Valley
Geconfronteerd met industriële achteruitgang, Wales droomt van Silicon Valley Hersenachtige computerchips kunnen privacyproblemen en broeikasgasemissies aanpakken
Hersenachtige computerchips kunnen privacyproblemen en broeikasgasemissies aanpakken
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

