
Wetenschap
Wetenschappers gebruiken licht om virale activiteit om te schakelen en ladingen naar cellen te brengen
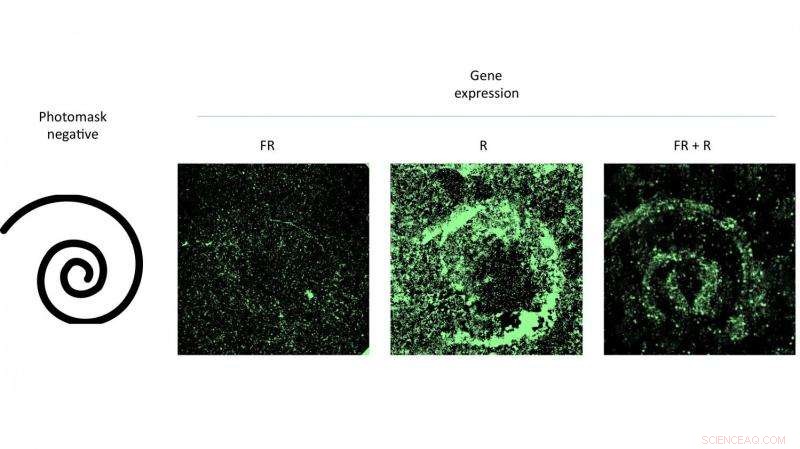
Het raken van een petrischaaltje met cellen die een gemodificeerd virus bevatten met een patroon van rood licht, stimuleerde genexpressie die overeenkwam met het patroon. Het experiment van wetenschappers van Rice University bewees de effectiviteit van een nieuw genafgiftesysteem dat met licht kan worden gecontroleerd. Krediet:Eric Gomez/Rice University
Licht helpt wetenschappers van Rice University om zowel de besmettelijkheid van virussen als de afgifte van genen aan de kernen van doelcellen te beheersen.
De onderzoekers hebben een methode ontwikkeld om twee tinten rood te gebruiken om het niveau en de ruimtelijke verdeling van genexpressie in cellen te regelen via een gemanipuleerd virus.
Hoewel virussen zijn geëvolueerd om genen in gastheercellen af te leveren, ze hebben nog steeds moeite om hun lading van het cytoplasma in de celkern te krijgen, waar genexpressie plaatsvindt. De Rice-laboratoria van bio-ingenieurs Junghae Suh en Jeffrey Tabor hebben met succes een manier gevonden om deze kritieke hindernis te overwinnen.
Het onderzoek van het team verschijnt deze week in het tijdschrift American Chemical Society ACS Nano .
Het resultaat van de laboratoria van Rice's BioScience Research Collaborative combineert Suh's interesse in het ontwerpen van virussen om genen af te leveren aan doelcellen met de vaardigheden van Tabor in optogenetica, waarin op licht reagerende eiwitten kunnen worden gebruikt om biologisch gedrag te beheersen.
Ze bouwden op maat gemaakte adeno-geassocieerde virus (AAV) vectoren door eiwitten op te nemen die van nature samenkomen wanneer ze worden blootgesteld aan rood licht (650 nanometer golflengten) en uiteenvallen wanneer ze worden blootgesteld aan verrood (750 nanometer golflengten). Deze van nature op licht reagerende eiwitten helpen de virale capsiden - de harde omhulsels die genetische ladingen bevatten - de gastheercelkernen binnen te gaan.
AAV was de voorkeursvector voor genbewerking door middel van CRISPR/Cas9, een techniek die veelbelovend is voor het genezen van sommige genetische ziekten, maar celkernen vormen een probleem, Zo zei.

Eric Gomez, afgestudeerd aan de Rice University, heeft een masker met een spiraalvormig patroon dat hij gebruikte om genexpressiepatronen in een petrischaaltje te controleren. Cellen in de schaal bevatten een gemodificeerd virus dat reageerde op rood licht en hun genetische lading afleverde aan de celkernen. Krediet:Jeff Fitlow/Rice University
"Virussen zijn over het algemeen relatief efficiënt in het afleveren van genen in cellen, maar ze ervaren nog steeds grote beperkende barrières, "zei ze. "Als je deze virussen aan cellen toevoegt, de meeste van hen lijken buiten de kern te hangen, en slechts een klein deel gaat naar binnen, dat is het doel."
Ze zei dat het team gebruik maakte van de expertise van het Tabor-lab op het gebied van optogenetica om de efficiëntie van de AAV's te vergroten. "Jeff werkt met veel verschillende soorten lichtgevoelige eiwitten. Het specifieke paar dat we hebben gekozen, werd voor het eerst geïdentificeerd in planten.
"Licht is heel fijn omdat je het van buitenaf kunt toepassen en je hebt veel controle over:op welke plekken het licht wordt belicht, de duur van de blootstelling, de intensiteit van het licht en, natuurlijk, zijn golflengte, " ze zei.
Het eiwitpaar omvat fytochroom B en zijn bindende partner fytochroom-interagerende factor 6 (PIF6), beide gevonden in zandraket. De onderzoekers genereerden gastheercellen die fytochroom B tot expressie brengen, gelabeld met een nucleaire lokalisatiesequentie, een klein peptide waarvan bekend is dat het helpt om eiwitten effectiever naar de kern te brengen. De kleinere PIF6 werd vervolgens bevestigd aan het buitenoppervlak van de viruscapside.
"Wanneer de virussen worden geïnternaliseerd in een gastheercel, ze hopen zich op natuurlijke wijze op rond de kern, Suh zei. "Onder niet-geactiveerde omstandigheden, de meeste virussen zitten daar vast. Maar als we rood licht op de cellen schijnen, deze twee plantaardige eiwitten dimeriseren - ze komen samen - en vanwege het nucleaire lokalisatielabel op het fytochroom B, het virus wordt de kern in gesleept."
Dit is de eerste keer dat optogenetische eiwitten zijn gebruikt om de besmettelijkheid van virussen te beheersen, ze zei, toevoegen, "We dachten niet dat het zo goed zou werken als het deed."

Rice University bio-ingenieur Junghae Suh, links, en afgestudeerde student Eric Gomez leidde een onderzoek waarin eiwitten die op licht reageren, virale capsiden hielpen om hun inhoud naar de celkernen te brengen. De onderzoekers zien hun techniek als een manier om genexpressie onder controle te houden. Krediet:Jeff Fitlow/Rice University
Hoofdauteur Eric Gomez, een afgestudeerde student in Suh's lab, en co-auteur Karl Gerhardt, een afgestudeerde student in het lab van Tabor, demonstreerde de techniek door patronen van AAV-geïnfecteerde cellen in petrischalen te activeren door er door middel van maskers rood licht op te schijnen.
Suh zei dat het platform in de toekomst kan worden gebruikt om te bepalen welke cellen en weefsels een gen tot expressie brengen en op welk niveau. De strategie kan ook worden gebruikt in toepassingen voor weefseltechnologie, zoals bioscaffolds voor implantatie. "Hier, misschien wil je stamcellen overhalen om zich op een soort van ruimtelijk gecoördineerde manier tot de juiste cellen te ontwikkelen, " ze zei.
Gebruik in het lichaam is verder weg, omdat extern toegepast rood licht slechts zo ver door weefsel gaat om doelen te bereiken. "Uiteindelijk, het zal afhangen van het apparaat dat je gebruikt om het licht te leveren, " zei ze. "Maar we stellen ons gevallen voor waarin je een katheter zou kunnen gebruiken om naar de plek te gaan waar je wilt dat de virussen veel besmettelijker zijn."
Suh zei dat de Rice-laboratoria eraan werken om de volgende generatie capsiden zowel effectiever als meer leverbaar te maken. "Dit is nog maar de eerste stap, "zei ze. "We hebben veel vragen, zoals 'Kunnen we dit echt in vivo doen?' soort vragen.
"Er zijn een handvol kranten geweest die probeerden het virusinfectieuze proces te laten reageren op licht, maar ze waren vóór het tijdperk van de optogenetica, Suh zei. "Ze gebruikten andere soorten synthetische moleculen om virussen lichtgevoelig te maken.
"Het lijkt erop dat het gebruik van wat Moeder Natuur al heeft geleverd in de vorm van op licht reagerende eiwitten heel goed voor ons werkt."
 Welke chemische verbindingen worden geacht verantwoordelijk te zijn voor de smaken van bitter, zuur, zout en zoet
Welke chemische verbindingen worden geacht verantwoordelijk te zijn voor de smaken van bitter, zuur, zout en zoet  Verschillen tussen HDPE-kunststof en polyetheen
Verschillen tussen HDPE-kunststof en polyetheen  Hoe zilver te recyclen in elektrische contacten
Hoe zilver te recyclen in elektrische contacten  Nieuwe beeldvormingsmethode helpt bij waterzuivering
Nieuwe beeldvormingsmethode helpt bij waterzuivering Het tij van plastic in de oceaan tegenhouden
Het tij van plastic in de oceaan tegenhouden
Hoofdlijnen
- Zebra-poepwetenschap verbetert de inspanningen voor natuurbehoud
- Is Rust Dust schadelijk?
- Waarom lijden 600 meisjes in Mexico aan collectieve hysterie?
- Dominant Allele: wat is het? & Waarom gebeurt het? "(with Traits Chart)
- Nieuwe vogelsoort genoemd naar Harvard-vader van biodiversiteit
- Antibioticaresistentie:slapende bacteriën die medicamenteuze behandeling kunnen overleven geïdentificeerd
- Biotechnologie en genetische manipulatie: een overzicht
- 10 planten verloren in de geschiedenis
- Galapagos-studie toont aan dat nieuwe soorten zich in slechts twee generaties kunnen ontwikkelen
- De vingerafdrukken van schadelijke moleculen niet-invasief detecteren via zwart silicium

- Nieuwe methode om grafeen van hoge kwaliteit te kweken, veelbelovend voor next-gen technologie

- Goedkope nano-apparaten uit de weg ruimen

- 'S Werelds eerste bloedtest voor realtime monitoring van het succes van kankerbehandelingen

- Vortexringen kunnen de celafgifte helpen, celvrije eiwitproductie

 Meteoor waarschijnlijk oorzaak van felle flits in de nachtelijke hemel van Florida
Meteoor waarschijnlijk oorzaak van felle flits in de nachtelijke hemel van Florida Het percentage afnemen
Het percentage afnemen Rovio-aandelen stegen naarmate de verkoop van Angry Birds 2 hoger vliegt
Rovio-aandelen stegen naarmate de verkoop van Angry Birds 2 hoger vliegt Het belang van DNA in de menselijke cel
Het belang van DNA in de menselijke cel  Wat houdt de toekomst van Kilauea in?
Wat houdt de toekomst van Kilauea in? Onderzoeksdoorbraak kan technologie voor schone energie transformeren
Onderzoeksdoorbraak kan technologie voor schone energie transformeren Bewijs gevonden van ultralage snelheidszone die mogelijk IJslandse pluim voedt
Bewijs gevonden van ultralage snelheidszone die mogelijk IJslandse pluim voedt Matchmaking voor zoete aardappel? Het is ingewikkeld
Matchmaking voor zoete aardappel? Het is ingewikkeld
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- Italian | Spanish | Portuguese | German | Dutch | Danish | French | Swedish | Norway |

-
Wetenschap © https://nl.scienceaq.com

