
Wetenschap
Welke verbindingen worden gevormd wanneer elementen van groep 7 met de lucht reageren?
Hier is een uitsplitsing van de reacties:
* fluor (f): Extreem reactief reageert fluor met lucht om fluormonoxide (f₂o) te vormen en fluordioxide (f₂o₂) . Deze zijn onstabiel en ontbinden gemakkelijk.
* chloor (CL): Chloor reageert langzaam met lucht, maar in aanwezigheid van vocht vormt het hypochlorous zuur (HOCL) , wat een sterke oxidatiemiddel is.
* Bromine (Br): Bromine verdampt gemakkelijk en in aanwezigheid van lucht vormt het bromine monoxide (br₂o) . Deze reactie is echter traag en vereist specifieke omstandigheden.
* jodium (i): Jodium reageert zeer langzaam met lucht om jodiumoxiden te vormen , maar de reactie is te verwaarlozen onder normale omstandigheden.
Het is belangrijk op te merken dat deze reacties complex zijn en afhankelijk zijn van factoren zoals temperatuur, vochtigheid en de aanwezigheid van andere stoffen.
Hier is een extra punt:
Halogenen reageren ook met water in de lucht en vormen halogenide-ionen (x-) en hypoHalous Acals (Hox) . Dit proces is belangrijk, vooral voor chloor, omdat het bijdraagt aan de vorming van chloorbleach en andere ontsmettingsverbindingen.
Samenvattend: Groep 7 -elementen reageren met lucht om oxiden te vormen, maar de reacties worden beïnvloed door verschillende factoren en het specifieke element.
 Variatie in de zachtheid van bouwstenen zorgt voor zachtere amorfe materialen
Variatie in de zachtheid van bouwstenen zorgt voor zachtere amorfe materialen  Een verbinding bestaande uit twee elementen die valentie -elektronen delen?
Een verbinding bestaande uit twee elementen die valentie -elektronen delen?  Bestrijding van kunstmatige trilhaartjes met magnetische velden en licht
Bestrijding van kunstmatige trilhaartjes met magnetische velden en licht Wat gebeurt er als een stof in water oplost?
Wat gebeurt er als een stof in water oplost?  Is een suikerkubus in heet water een voorbeeld van diffusie gevallen?
Is een suikerkubus in heet water een voorbeeld van diffusie gevallen?
 Zoeken en redden:onderzoekers op missie om de koraalriffen van Zuid-Florida te redden
Zoeken en redden:onderzoekers op missie om de koraalriffen van Zuid-Florida te redden Everest:ik reisde de doodszone in om 's werelds hoogste weerstation te installeren
Everest:ik reisde de doodszone in om 's werelds hoogste weerstation te installeren Verborgen kosten - hoe infrastructuurontwikkeling de illegale handel in wilde dieren kan aanwakkeren?
Verborgen kosten - hoe infrastructuurontwikkeling de illegale handel in wilde dieren kan aanwakkeren? Onderzoek naar natte brandrook in wolken:kan water de opwarming van de aarde intensiveren?
Onderzoek naar natte brandrook in wolken:kan water de opwarming van de aarde intensiveren?  10 dingen die u kunt doen om de aarde te helpen redden
10 dingen die u kunt doen om de aarde te helpen redden
Hoofdlijnen
- Wat bevat bundels buisachtige cellen die water en voedsel vervoeren?
- Een soort weefsel dat elektrische signalen door het lichaam verzendt?
- Delen van de menselijke hiel
- Het menselijke genoom is gemaakt van 46?
- Deze oude slang in India was misschien langer dan een schoolbus en woog een ton
- Van chimpansees is aangetoond dat ze zelfs als volwassenen vaardigheden op het gebied van het gebruik van gereedschap leren en verbeteren
- Wat is de functie van Menisci?
- Gebruik van DNA-extractie
- Onderzoekers ontsluiten hoe cellen hun functies bepalen
- Wetenschappers ontwerpen nieuwe metabole technologie om wetenschappelijke gegevens voor iedereen te openen

- Atomair dunne perovskieten boost voor toekomstige elektronica

- Zullen sterke en snel wisselende kunstmatige spieren haalbaar zijn?
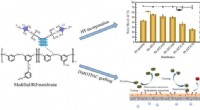
- Nieuwe technologie om de hoge permselectiviteit en anti-biofouling eigenschappen van RO-membranen te verbeteren
- Kleine kooien kunnen vaccins veilig houden bij hoge temperaturen
 Studie voorspelt een aanzienlijk drogere wereld bij 2 C
Studie voorspelt een aanzienlijk drogere wereld bij 2 C Nieuwe verkiezingssystemen gebruiken kwetsbare software
Nieuwe verkiezingssystemen gebruiken kwetsbare software Waarom is mangaan erg reactief?
Waarom is mangaan erg reactief?  Brengt de chemische vergelijking van ATP exergonische exotherme exotherme of absorbeert energie -endergonisch endotherm?
Brengt de chemische vergelijking van ATP exergonische exotherme exotherme of absorbeert energie -endergonisch endotherm?  Het dollarwinkeldieet:onderzoek toont aan dat kortingsproducten overeenkomen met de kwaliteit van traditionele ketens
Het dollarwinkeldieet:onderzoek toont aan dat kortingsproducten overeenkomen met de kwaliteit van traditionele ketens Honderden scholen gesloten omdat bosbrandnevel Zuidoost-Azië bedekt
Honderden scholen gesloten omdat bosbrandnevel Zuidoost-Azië bedekt Hoe een Climatogram maken
Hoe een Climatogram maken  Impact Speed
Impact Speed
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

