
Wetenschap
Een verbinding bestaande uit twee elementen die valentie -elektronen delen?
Dit is waarom:
* Covalente binding: Bij covalente binding delen atomen hun valentie -elektronen (elektronen in de buitenste schaal) om een stabiele elektronenconfiguratie te bereiken. Dit delen creëert een sterke aantrekkingskracht tussen de atomen en houdt ze bij elkaar in een molecuul.
* niet -metalen: Covalente verbindingen worden meestal gevormd tussen niet -metalen, omdat niet -metalen de neiging hebben om elektronen te winnen in plaats van ze te verliezen. Dit maakt het delen van elektronen een gunstiger optie.
Voorbeelden van covalente verbindingen:
* water (h₂o): Waterstof en zuurstof delen elektronen om een stabiel molecuul te vormen.
* koolstofdioxide (co₂): Koolstof deelt elektronen met twee zuurstofatomen.
* methaan (ch₄): Koolstof deelt elektronen met vier waterstofatomen.
Laat het me weten als je meer voorbeelden wilt of specifieke eigenschappen van covalente verbindingen wilt verkennen!
Hoofdlijnen
- Wat eet FOGS?
- Hoe het boren naar olie in het Arctic National Wildlife Refuge van invloed kan zijn op dieren in het wild
- Warmteminnende Australische mieren geloven in diversiteit, hint 74 soorten nieuw voor de wetenschap
- Nieuwe kaarten laten zien dat de krimpende wildernis op eigen risico wordt genegeerd
- Waarom vechten dieren tegen leden van andere soorten?
- Alle lipiden zijn wat?
- Kleine gouden sondes geven wetenschappers een idee van hoe ziekten zich ontwikkelen
- Onderzoekers gebruiken kunstmatige membranen om te laten zien hoe een bepaald eiwit de mitochondriën bereikt
- Wat werd het raster gebruikt om overervingpatronen op basis van genotype -ouders die werden genoemd?
- Garens bedekt met enzymen kunnen als filters werken

- Onderzoekers krijgen nieuwe inzichten in een dynamisch eiwit gericht op kankertherapie
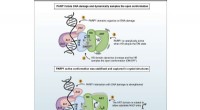
- Een moleculaire snelkookpan maakt taaie stukjes eiwit mals en helpt af te bijten
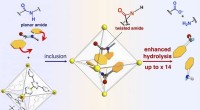
- Nieuwe techniek om de bron van voedselvergiftiging te lokaliseren
- Een materiaal voor thermisch beheer dat reageert op warmte of kou door het in- of uit te vouwen zonder dat er een stroombron nodig is

 Waarom waren wetenschappers verrast toen ze steenkool vonden in het noordpoolgebied?
Waarom waren wetenschappers verrast toen ze steenkool vonden in het noordpoolgebied?  Hoe compressieve sterkte te berekenen
Hoe compressieve sterkte te berekenen Waarom heeft het universum zichzelf niet vernietigd? Neutrino's kunnen het antwoord bevatten
Waarom heeft het universum zichzelf niet vernietigd? Neutrino's kunnen het antwoord bevatten Video:Is uw katalysator gestolen? Dit is waarom
Video:Is uw katalysator gestolen? Dit is waarom Wat is een ingenieursdoel in een wetenschapsproject?
Wat is een ingenieursdoel in een wetenschapsproject?  Ideeën voor het laten vallen van eieren
Ideeën voor het laten vallen van eieren  Weerspiegelt de zuurgraad van een oplossing de vrije waterstofionen in oplossing?
Weerspiegelt de zuurgraad van een oplossing de vrije waterstofionen in oplossing?  Kunstmatige intelligentie om eiwitstructuur te voorspellen
Kunstmatige intelligentie om eiwitstructuur te voorspellen
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com


