
Wetenschap
Reageren koolstof met chloor om een ionische verbinding te vormen?
* Elektronegativiteitsverschil: Koolstof en chloor hebben een significant verschil in elektronegativiteit (chloor is veel elektronegatief). Dit verschil kan duiden op ionische binding. Echter...
* de bindingsvoorkeur van koolstof: Carbon geeft de voorkeur aan covalente bindingen, het delen van elektronen in plaats van ze volledig over te dragen. Het heeft vier valentie -elektronen en heeft de neiging om vier covalente bindingen te vormen om een stabiele octetconfiguratie te bereiken.
* de bindingsvoorkeur van chloor: Chloor, hoewel zeer elektronegatief, geeft ook de voorkeur aan covalente bindingen. Het heeft nog een elektron nodig om zijn octet te voltooien.
Wat gebeurt er in plaats daarvan?
Koolstof en chloor reageren op vorm covalente verbindingen , specifiek koolstoftetrachloride (CCL4) . In deze verbinding deelt Carbon zijn vier valentie -elektronen met vier chlooratomen, wat vier sterke covalente bindingen vormt.
 Onderzoekers ontwikkelen computermodel om te voorspellen of een bestrijdingsmiddel schadelijk is voor bijen
Onderzoekers ontwikkelen computermodel om te voorspellen of een bestrijdingsmiddel schadelijk is voor bijen Hoe worden de buitenste schelpen van twee atomen die covalent zijn gebonden?
Hoe worden de buitenste schelpen van twee atomen die covalent zijn gebonden?  Nieuwe familie in de buurt:een nieuwe groep glycosidische enzymen
Nieuwe familie in de buurt:een nieuwe groep glycosidische enzymen Is methaan een natuurlijk element dat deel uitmaakt van de atmosfeer?
Is methaan een natuurlijk element dat deel uitmaakt van de atmosfeer?  Hoeveel pi-bindingen in melkzuur?
Hoeveel pi-bindingen in melkzuur?
 Uit onderzoek blijkt dat eilandbewoners in de Stille Oceaan vuur gebruikten om landschappen vorm te geven
Uit onderzoek blijkt dat eilandbewoners in de Stille Oceaan vuur gebruikten om landschappen vorm te geven  Lahar-detectiesysteem geüpgraded voor Mount Rainier
Lahar-detectiesysteem geüpgraded voor Mount Rainier  Klimaatverandering omkeren:is houtskool het antwoord?
Klimaatverandering omkeren:is houtskool het antwoord?  Maria haalt uit naar Amerikaanse Maagdeneilanden terwijl Puerto Rico zich voorbereidt op impact
Maria haalt uit naar Amerikaanse Maagdeneilanden terwijl Puerto Rico zich voorbereidt op impact Wetenschappers selecteren het beste potentiële verdampingsmodel voor stroomgebieden in China
Wetenschappers selecteren het beste potentiële verdampingsmodel voor stroomgebieden in China
Hoofdlijnen
- Wat zijn de primaire functies van fosfolipiden?
- Hoeveel gemeenschappelijke namen een organisme ook heeft, heeft het er maar één?
- Welke rol spelen lipidemoleculen bij het semipermeabel maken van het celmembraan?
- Wat het soort vragen dat niet door de wetenschap kan worden beantwoord?
- Wat is fylogenetica?
- Wat is het verschil tussen het reproductieve systeem in de mens en een worm?
- Geen zoetekauw meer? De wetenschap schakelt het verlangen naar suiker bij muizen uit
- Waarom evolutie vaak de voorkeur geeft aan kleine dieren en andere organismen
- Uit onderzoek blijkt dat harige dieven loslopen in een bos in Maine
- Upconversie-fluorescentie in metalen organische raamwerken

- Nieuwe kopercoating zou de volgende superbug-jager kunnen zijn

- Doorbraak in synthese van scheikundigen bevordert een krachtig middel tegen kanker

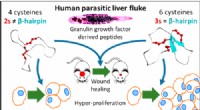
- Een molecuul geproduceerd door een Thaise leverparasiet zou de oplossing kunnen zijn voor die niet-genezende wonden
- Hoge reactiesnelheden, zelfs zonder edele metalen

 Uit welke materialen bestaat een spons?
Uit welke materialen bestaat een spons?  Wat is de energie voor proces die plaatsvindt in chloroplasten?
Wat is de energie voor proces die plaatsvindt in chloroplasten?  Welk type macromolecuul produceren gladde en ruwe ER?
Welk type macromolecuul produceren gladde en ruwe ER?  Seks in de ochtend of avond?
Seks in de ochtend of avond?  Onderzoekers ontwikkelen alternatief voor verspillend methaan affakkelen
Onderzoekers ontwikkelen alternatief voor verspillend methaan affakkelen Forensische onderzoekers lopen het risico bewijs te missen in omgevingen met weinig licht, volgens nieuw onderzoek
Forensische onderzoekers lopen het risico bewijs te missen in omgevingen met weinig licht, volgens nieuw onderzoek Botsingen van licht produceren materie/antimaterie uit pure energie
Botsingen van licht produceren materie/antimaterie uit pure energie Wat gebeurde er met de grotere asteroïde Didymos nadat DART op Dimorphous was ingeslagen?
Wat gebeurde er met de grotere asteroïde Didymos nadat DART op Dimorphous was ingeslagen?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

